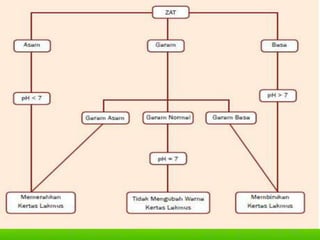
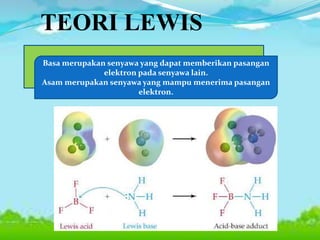
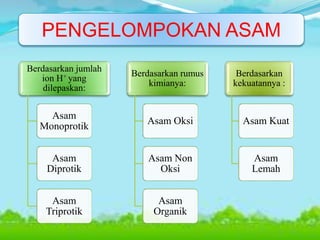
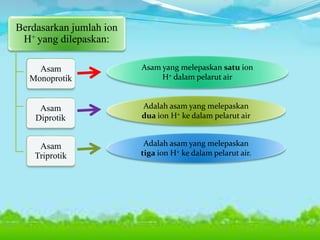
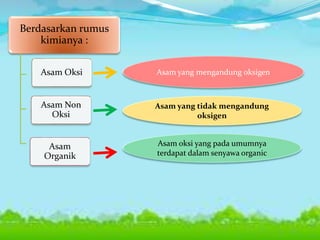
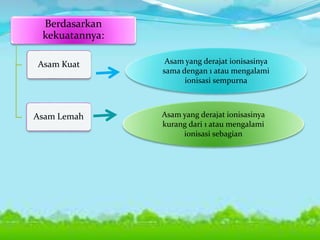
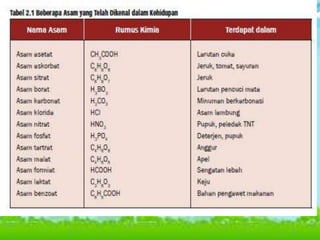
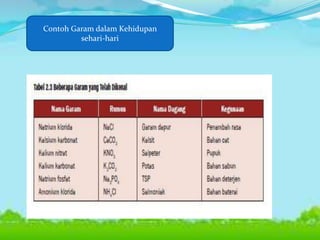
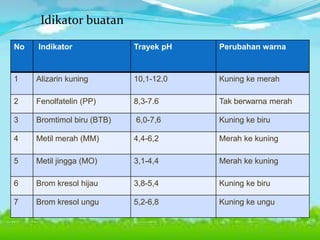
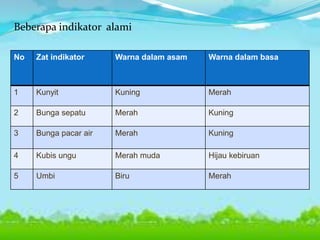
Dokumen ini membahas konsep asam, basa, dan garam dalam sains, menjelaskan berbagai teori seperti Arrhenius, Brønsted-Lowry, dan Lewis. Selain itu, dijelaskan pengelompokan asam dan basa berdasarkan kebanyakan ion yang dilepaskan, serta prosedur identifikasi menggunakan indikator. Contoh reaksi pembentukan garam dan cara mengukur pH juga disertakan.