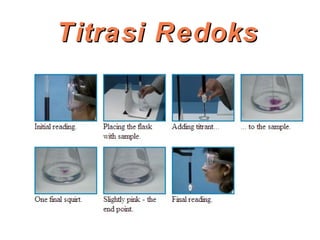
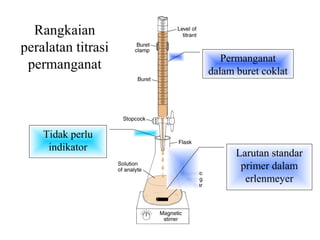
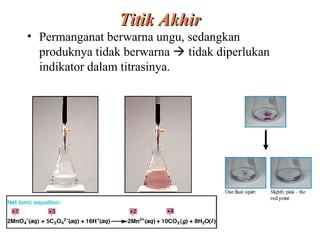
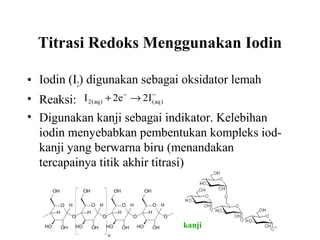
Dokumen ini membahas metode titrasi redoks, termasuk penggunaan KMnO4 dan K2Cr2O7 sebagai oksidator, serta standar primer yang digunakan untuk menstandarisasi larutan tersebut. Titik ekivalen ditentukan melalui reaksi yang terkontrol, dan beberapa contoh aplikasi serta kondisi eksperimen dijelaskan. Juga dibahas tantangan yang dihadapi saat menggunakan KMnO4 dan proses titrasi dengan iodin sebagai oksidator lemah.