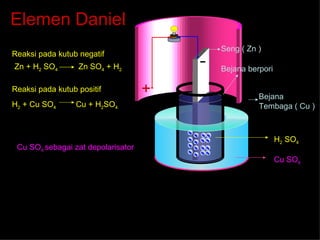
Sumber tegangan merupakan alat yang menciptakan beda potensial, dibagi menjadi sumber arus bolak-balik (AC) dan arus searah (DC), dengan dua kategori berdasarkan daya isi ulang: primer dan sekunder. Contoh sumber tegangan termasuk elemen volta, baterai, dan akumulator yang memiliki berbagai reaksi kimia pada kutub positif dan negatif. Penggunaan dan pengisian akumulator melibatkan aliran arus listrik yang berbeda dengan saat digunakan.