More Related Content
PDF
พันธะเคมี Part ionic bonds PPT
พันธะเคมี Part ionic bonds PDF
PPT
PDF
PDF
พันธะโคเวเลนต์ Covalent Bond PPTX
PDF
What's hot
PDF
PDF
PDF
PDF
ธาตุและสารประกอบ (elements and compound) PPTX
PPT
PPT
PPT
PPT
PDF
PPT
สมบัติของธาตุและสารประกอบ2 PPT
PDF
PDF
พันธะเคมี - Chemical bonds PDF
บทที่ 3 สมบัติของธาตุและสารประกอบ PDF
PPT
PDF
มวลอะตอม มวลโมเลกุล มวลไอออน PDF
Similar to พันธะเคมี1
PPT
PPT
PPT
PDF
พันธะเคมี-(Chemical Bonding)มทร.ล้านนา.pdf PDF
SLIDE-01403117-CH02-CHEMICALBOND-FULL.pdf PDF
PDF
PPT
PPTX
PDF
PDF
PDF
PDF
PDF
PDF
PDF
PDF
PPT
PDF
PDF
พันธะเคมี1
- 1.
- 2.
- 3.
พันธะเคมีแรงยึดเหนี่ยวทางเคมี แบ่งเป็น 2ประเภท คือแรงยึดเหนี่ยวระหว่างอะตอม(ภายนอก) ได้แก่ พันธะโลหะ พันธะไอออนิก พันธะโคเวเลนต์ พันธะโคออดิเนตโคเวเลนต์แรงยึดเหนี่ยวระหว่างโมเลกุล(ภายใน) เกินกับโมเลกุลโคเวเลนต์เท่านั้น ได้แก่ แรงวันเดอร์วาล พันธะไฮโดรเจนแรงยึดเหนี่ยวระหว่างอะตอม(ภายนอก) - 4.
พันธะโลหะMetallic bondแรงยึดเหนี่ยวที่ทำให้อะตอมของโลหะ อยู่ด้วยกันในก้อนของโลหะโดยมีการใช้ เวเลนต์อิเล็กตรอนร่วมกันของอะตอมของโลหะ โดยที่เวเลนต์อิเล็กตรอนนี้ไม่ได้เป็นของอะตอมหนึ่งอะตอมใดโดยเฉพาะ เนื่องจากมีการเคลื่อนที่ตลอดเวลา ทุกๆอะตอมของโลหะจะอยู่ติดกันกับอะตอมอื่นๆ ต่อเนื่องกันไม่มีที่สิ้นสุด จึงทำให้โลหะไม่มีสูตรโมเลกุล ที่เขียนกันเป็นสูตรอย่างง่าย หรือสัญลักษณ์ของธาตุนั้นเอง-----+++-------Sea of electrons+++----------------อิเล็กตรอนอิสระ (วาเลนซ์อิเล็กตรอน)--+++--------++-+--------------+++-----------+++----เวเลนซ์อิเล็กตรอนมาก พันธะแข็งแรงมาก - 5.
- 6.
- 7.
- 8.
- 9.
- 10.
โลหะนำความร้อนได้ดี เพราะอิเล็กตรอนอิสระเคลื่อนที่ได้ทุกทิศทางพันธะไอออนิก IonicBondพันธะที่เกิดขึ้นอันเนื่องมาจากแรงดึงดูดทางไฟฟ้าสถิตระหว่างไอออนบวก และไอออนลบ อันเนื่องมาจากการถ่ายโอนอิเล็กตรอน จากโลหะให้แก่อโลหะโดยทั่วไปแล้วพันธะไอออนิกเป็นพันธะที่เกิดขึ้นระหว่างโลหะและอโลหะ ทั้งนี้เนื่องจากว่าโลหะมีค่าพลังงานไอออไนเซชัน IE ต่ำ แต่อโลหะมีค่าสัมพรรคภาพอิเล็กตรอน EA สูง ดังนั้นโลหะจึงมีแนวโน้มที่จะให้อิเล็กตรอน และอโลหะมีแนวโน้มที่จะรับอิเล็กตรอน อะตอม EN ต่ำ:ให้อิเล็กตรอนไอออนบวก(โลหะ) อะตอม EN สูง:รับอิเล็กตรอนไอออนลบ (อโลหะ) - 11.
M+ (g) + X (g) MX(s) + lattice energy - 12.
- 13.
- 14.
- 15.
- 16.
- 17.
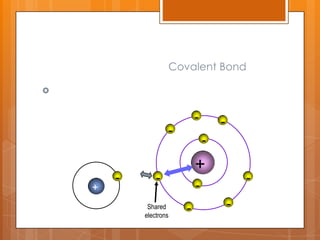
อะตอมที่ใช้อิเล็กตรอนร่วมกันเรียกว่า อะตอมคู่ร่วมพันธะถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 1 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะเดี่ยว เช่น ในโมเลกุลของไฮโดรเจน - 18.
- 19.
ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะสาม เช่น ในโมเลกุลของไนโตรเจนพันธะโคออร์ดิเนตโคเวเลนต์Coordinate Covalent BondH. .....พันธะโคเวเลนต์ที่เกิดจากการใช้อิเล็กตรอนร่วมกันของอะตอมโดยอิเล็กตรอนคู่นี้มาจากอะตอมใดอะตอมหนึ่งไม่ได้มาจากทั้ง 2 อะตอม การเกิดพันธะจะเกิดเมื่อเกิดพันธะโคเวเลนต์ตามปกติ แล้วยังมีอะตอมใดอะตอมหนึ่งที่เวเลนซ์อิเล็กตรอนยังไม่ครบตามกฎออกเตตHHN. .H