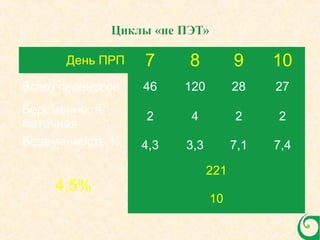
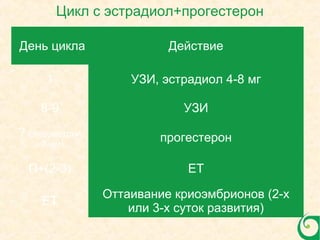
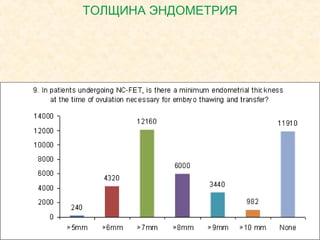
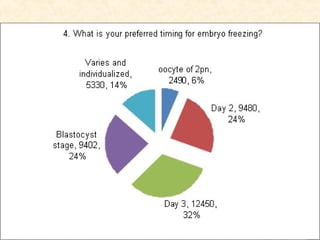
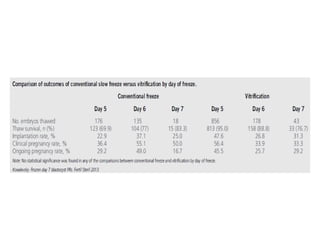
Документ обсуждает криопротоколы для переноса криоконсервированных эмбрионов и эффективность разных методов в вспомогательной репродуктивной технологии. Он подчеркивает важность индивидуализации подходов к переносу эмбрионов, а также описывает факторы, влияющие на имплантацию, включая «имплантационное окно». В заключение, авторы отмечают недостаток сильных доказательств для предпочтения одного метода над другим в современных вмешательствах.