PPT - SISTEM PERIODIK
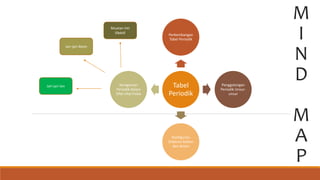
- 1. M I N D M A P Tabel Periodik Perkembangan Tabel Periodik Penggolongan Periodik Unsur- unsur Konfigurasi Elektron Kation dan Anion Keragaman Periodik dalam Sifat-sifat Fisika Muatan Inti Efektif Jari-jari Atom Jari-jari Ion
- 3. 1. Logam dan Nonlogam Antione Lavoisier LOGAM Besi (Fe) Perak (Ag) Tembaga (Cu) Kobalt (Co) Platina (Pt) NONLOGAM Karbon (C) Fosfor (P) Unsur terbagi menjadi dua golongan yaitu logam dan non logam Sumber: www.commons.wikimedia.org/David Pinoct
- 4. Pengelompokkan unsur-unsur berdasarkan “kesamaan sifat dan dan diurutkan massa atomnya”. Maka setiap unsur yang ditengah merupakan rata-rata dari massa unsur yang ditepi. 2. Tride Dobereinor Pada tahun 1829, Johan Wolfgang Dobereiner
- 5. 3. Oktaf Newlands " Jika unsur unsur disusun berdasarkan kenaikan massa atom relatifnya, maka unsur dengan urutan kedelapan sifatnya mirip dengan unsur pertama, unsur kesembilan mirip dengan unsur kedua, dan seterusnya. Artinya akan terdapat pengulangan kemiripan sifat setiap delapan unsur" Pada tahun 1865, Newland
- 6. 4. TEORI MENDELEEV “Unsur-unsur disusun 12 baris mendatar (periode) berdasarkan kenaikan massa atom dan 8 kolom tegak (golongan) berdasarkan kemiripan sifat.” Mendeleev menyiapkan tempat kosong dengan keyakinan banyak unsur yang belum ditemukan tahun 1869, seorang sarjana asal Rusia bernama Dmitri Ivanovich Mendeleev
- 7. “Unsur-unsur dalam satu periode disusun berdasarkan kenaikan nomor atom dan unsur dalam satu golongan disusun berdasarkan kemiripan dalam sifat fisika dan kimia” 5. Sistem Periodik Modern tahun 1914, Henry G. J. Moseley H. G. J. Moseley membuat sistem periodik modern untuk menyempurnakan klasifikasi unsur Mendeleev
- 10. Golongan Golongan adalah susunan unsur-unsur dalam SPU ke arah tegak (vertikal) yang disusun berdasarkan kemiripan sifat. Golongan Utama (A) Golongan Transisi (B) Periode Periode adalah susunan unsur-unsur dalam SPU arah mendatar (horizontal) yang disusun berdasarkan kenaikan nomor atom. Periode pendek Periode panjang
- 11. • berisi unsur-unsur sejenis • Penentuannya berdasarkan jumlah electron valensi • terbagi menjadi 4 blok (berd. Subtingkat energi): s, p, d, dan f • terbagi menjadi 3 kelompok: golongan unsur utama(A), unsur transisi(B), dan transisi dalam
- 12. Alkali Alkalitanah karbon Boron-alumunium GasMulia oksigen Halogen nitrogen Golongan periode Logam transisi (golongan B) Logam transisi dalam Lantanida Aktinida
- 13. Unsur Golongan IA (Logam Alkali) Sifat dari Logam Alkali adalah sangat reaktif. Karena sangat reaktif Alkali susah menemukan dalam bentuk tunggal Sifat alkali lainnya adalah dapat terbakar di udara, bereaksi hebat dengan air, dan termasuk logam yang ringan. Unsur Golongan IIA (Logam Alkali Tanah) Sifat dari Logam Alkali Tanah adalah dapat membentuk basa dengan senyawa lain, tetapi kurang larut dengan air. Dapat ditemukan dalam tanah. Hampir sama sifatnya dengan Logam Alkali, yaitu mudah terbakar, logam aktif, tetapi dengan kereaktifannya kurang sehingga akan terbakar jika di udara bila dipanaskan.
- 14. Unsur Golongan VIIA (Halogen) Sifatnya bereaksi dengan logam membentuk garam. Keelektronegatifan tertinggi, jadi Halogen merupakan golongan paling non-logam. Unsur halogen umumnya berbentuk dwi-atom. Sifat lainnya adalah berwarna dan bersifat racun. Contoh Senyawa yang terikat dengan Halogen NaBr, NaCl , dan NaI. Unsur Golongan VIIIA (Gas Mulia) Unsur-unsur pada golongan gas mulia sangatlah stabil dan karena stabil, jadi sangat sukar bereaktif dengan unsur lain. Itu semua karena konfigurasi elektronnya yang terisi penuh, Sifat lainnya adalah energi ionisasinya yang sangat besar dan afinitas elektronnya yang sangat rendah, berupa gas. Selain itu gas mulia memiliki titik cair dan titik didih yang sangat rendah.
- 15. Sifat dari logam transisi adalah termasuk logam dan merupakan penghantar listrik yang baik, massa jenis yang tinggi, dan titik didih dan titik leleh yang tinggi, Lantanida Lantanida adalah kelompok unsur kimia yang terdiri dari 15 unsur, mulai lantanum (La) sampai lutetium (Lu) pada tabel periodik, dengannomor atom 57 sampai 71. Laktanida sering disebut sebagai tanah jarang. Karena lantanida memiliki sifat yang sangat mirip dan sukar dipisahkan satu sama lain Aktinida Aktinida adalah kelompok unsur kimia yang mencakup 15 unsur antara aktinium dan lawrensium pada tabel periodik, dengan nomor atom antara 89 sampai dengan 103. Semua unsur aktinida bersifat radioaktif dan sangat beracun.
- 16. Golongan unsur transisi dalam 1. Lantanida : 4f 2. Aktinida : 5f Rumus: 1. Blok s: nsx 2. Blok p: nsx npy 3. Blok d: nsx (n-1)dy 4. Blok f : nsx (n-2)fy
- 17. Periode (horizontal) • berdasarkan kenaikan nomor atom • Penentuannya berdasarkan jumlah kulit terbesar • terbagi menjadi 4, yaitu:
- 18. Konfigurasi electron kation dan Anion Cara-cara unsur mencapai kestabilan : Melepas elektron membentuk ion positif, yaitu untuk unsur yang memiliki elektron valensi 1 s/d 3 (golongan I A s/d Golongan III A). Contoh : Na+, Mg2+, Al3+, dsb. Na: [Ne] 3s1 Na+ : [Ne] Ca: [Ar] 4s2 Ca2+: [Ar] Al: [Ne] 3s2 3p1 Al3+ : [Ne] Menangkap elektron membentuk ion negatif, yaitu untuk unsur yang memiliki elektron valensi 5 s/d 7 (golongan V A s/d VII A). Contoh : Cl-, S2-, P3-, dsb. F: 1s2 2s2 2p5 F- : 1s2 2s2 2p6 [Ne] O: 1s2 2s2 2p4 O2- : 1s2 2s2 2p6 [Ne] N: 1s2 2s2 2p3 N3- : 1s2 2s2 2p6 [Ne]
- 19. Cara menentukan letak golongan dan periode Tentukan golongan unsur-unsur yang mempunyai nomor atom sebagai berikut: 1. 11Na 2. 31Ga 3. 26Fe kunci Jawaban 1. 11Na : 1s2 2s2 2p6 3s1 Elektron valensi pada 3s (ns) berjumlah 1 = Golongan IA Bilangan n terbesar 3 = Periode 3 2. 31Ga : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 Elektron valensi pada 4s 4p (ns np) berjumlah 3 = Golongan IIIA Bilangan n terbesar 4 = Periode 4 3. 45Rh : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d7 5s2 Elektron valensi pada 5s 4d (ns (n-1)d) berjumlah 9 = Golongan VIIIB Bilangan n terbesar 5 = Periode 5
- 21. Muatan Inti Efektif muatan total dari inti atom yang dirasakan oleh elektron terluar. Muatan inti efektif mempengaruhi jari-jari atom, energi ionisasi dan afinitas elektron. Dinyatakan bahwa : • Dalam satu golongan, dari atas ke bawah, muatan inti efektif akan semakin kecil. • Dalam satu periode, dari kiri ke kanan, muatan inti efektif akan semakin besar.
- 22. jarak antar inti atom dengan kulit atom terluar. Jari-jari Atom Dinyatakan bahwa : o Dalam satu golongan, dari atas ke bawah, jari- jari atom akan semakin besar. Karena kulit atom bertambah o Dalam satu periode, dari kiri ke kanan, jari-jari atom akan semakin kecil. Karena jumlah proton bertambah, gaya Tarik inti makin kuat, sehingga jari-jari atom makin kecil
- 23. Jari-jari Ion Pelepasan electron menghasilkan ion positif yang disebut kation , dan penyerapan electron menghasilkan ion negative yang disebut anion. Kecendrungan jari-jari ion: Ion positif memiliki jari jari lebih kecil dari atom netral Ion negative memiliki jari jari lebih besar dari atom netral Jari-jari ion (ionic radius) adalah jari-jari kation atau anion.
- 24. Terima Kasih