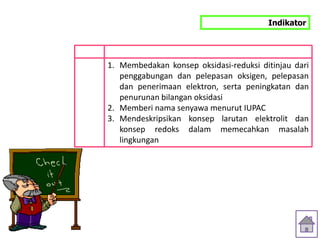
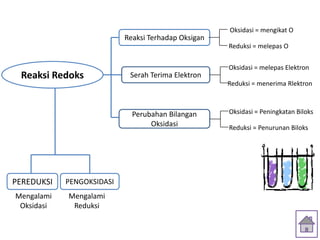
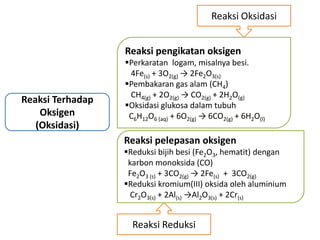
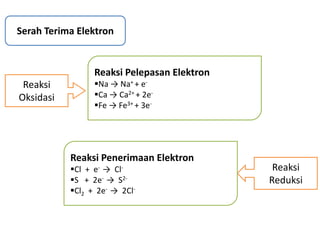
Oksidasi adalah reaksi pengikatan oksigen, sedangkan reduksi adalah reaksi pelepasan oksigen. Oksidasi adalah reaksi pelepasan elektron, sedangkan reduksi adalah reaksi penerimaan elektron. Oksidasi menyebabkan peningkatan bilangan oksidasi, sedangkan reduksi menyebabkan penurunan bilangan oksidasi.
a. +5
b. -3
c. +6





![BILANGAN OKSIDASI
Nilai muatan (berharga positif atau negatif) dari atom dalam
pembentukan suatu molekul atau ion
Ketentuan-ketentuan dalam menentukan biloks
1. Bilangan oksidasi satu unsur bebas = 0
2. Bilangan oksidasi satu atom hidrogen = + 1
3. Bilangan oksidasi satu atom oksigen = -2
4. Bilangan oksidasi logam, selalu positip sesuai nomor golongannya. Kecuali
untuk atom transisi. Logam alkali selalu +1 dan alkali tanah selalu +2
5. Jumlah bilangan oksidasi atom-atom penyusun suatu ion = jumlah
muatannya.
Contoh = biloks NO3- = -1 , NH4+ = +1
6. Jumlah bilok semua unsur pembentuk senyawa = 0
NH3 = (1x b.o N) + (3x b.o H)
0 = [1x(-3)] + [3x(+1)]](https://image.slidesharecdn.com/redoks-120804191901-phpapp01/85/Redoks-11-320.jpg)

