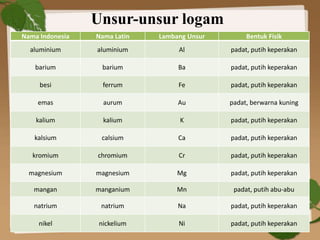
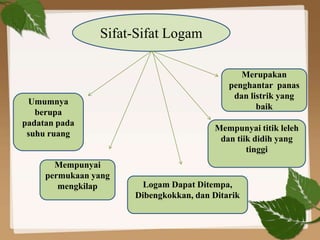
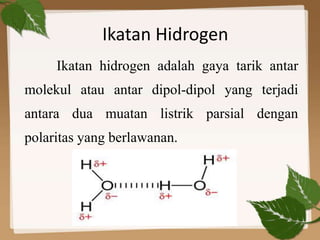
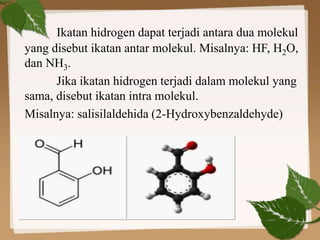
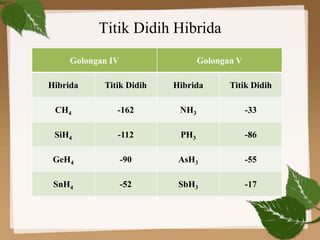
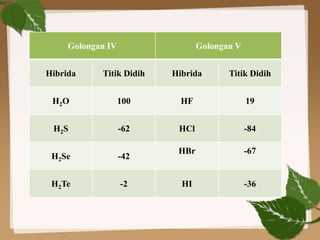
Dokumen ini membahas ikatan kimia, khususnya ikatan logam, hidrogen, dan gaya van der Waals. Ikatan logam terjadi antara atom-atom logam dengan elektron bebas yang memungkinkan konduktivitas listrik, sedangkan ikatan hidrogen dan gaya van der Waals merupakan gaya tarik-imegan antar molekul yang berperan dalam sifat fisik senyawa. Selain itu, kekuatan ikatan ini mempengaruhi titik leleh dan titik didih berbagai senyawa.