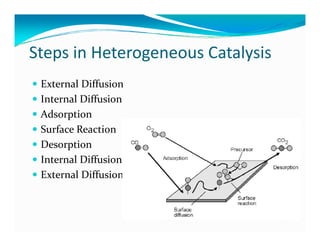
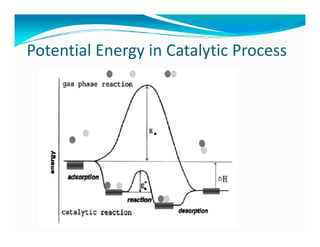
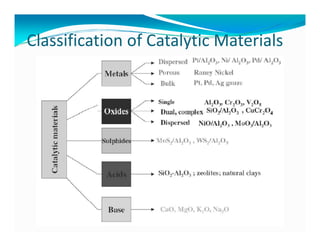
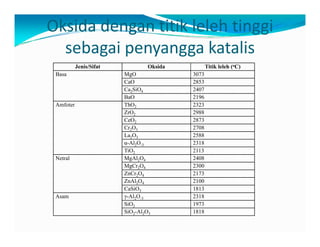
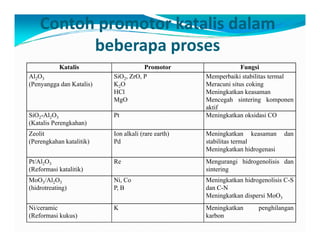
Dokumen ini membahas teknologi katalis, termasuk berbagai jenis katalis seperti homogen, enzim, dan heterogen, serta manfaat peningkatan aktivitas katalis dalam reaksi kimia. Penjelasan menyentuh pada desain katalis, pemilihan komponen aktif, dan peran penyangga serta promotor dalam meningkatkan efisiensi dan stabilitas katalis. Faktor-faktor seperti struktur permukaan dan kondisi proses juga dibahas untuk optimasi katalisis dalam industri.