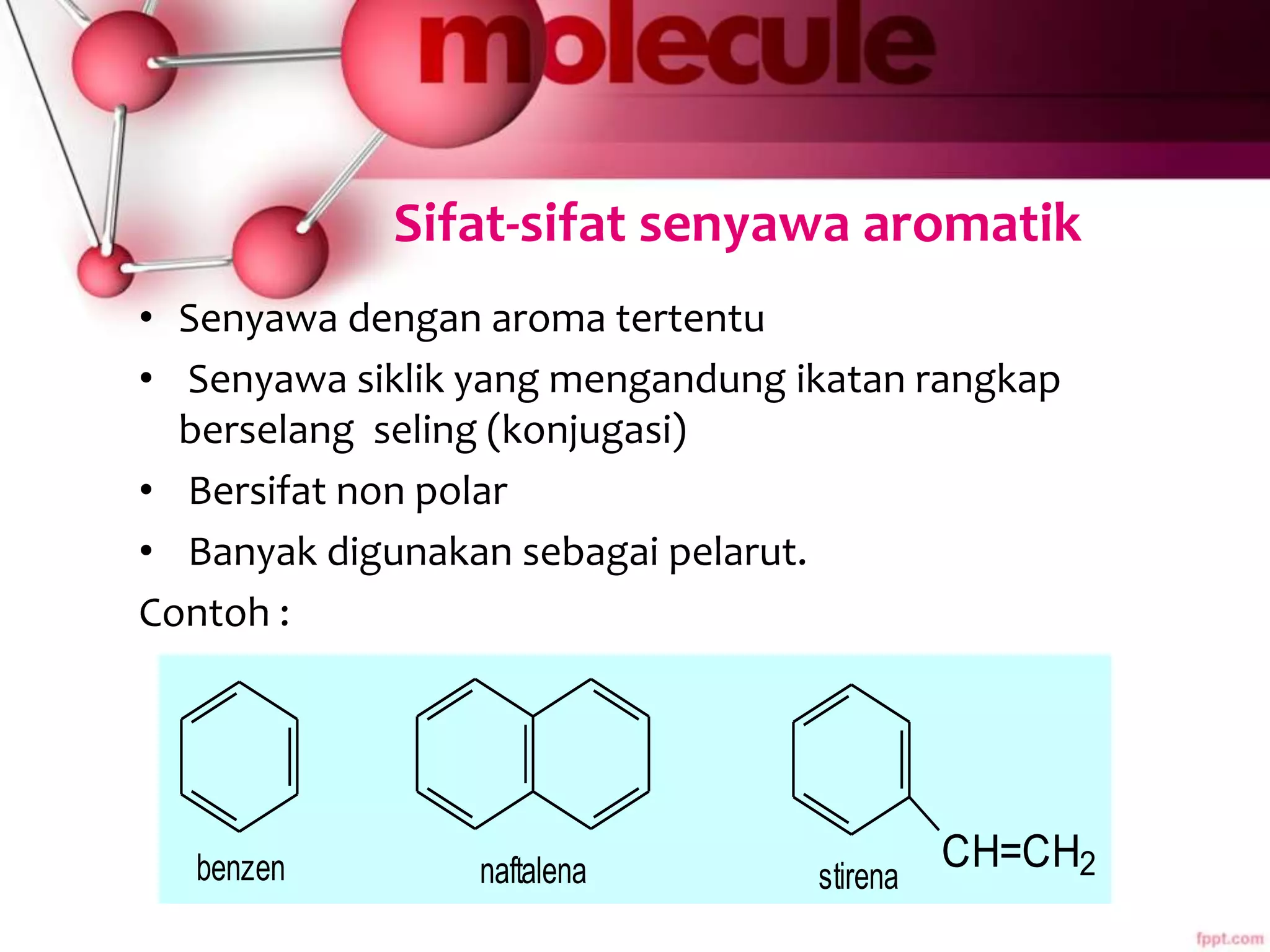
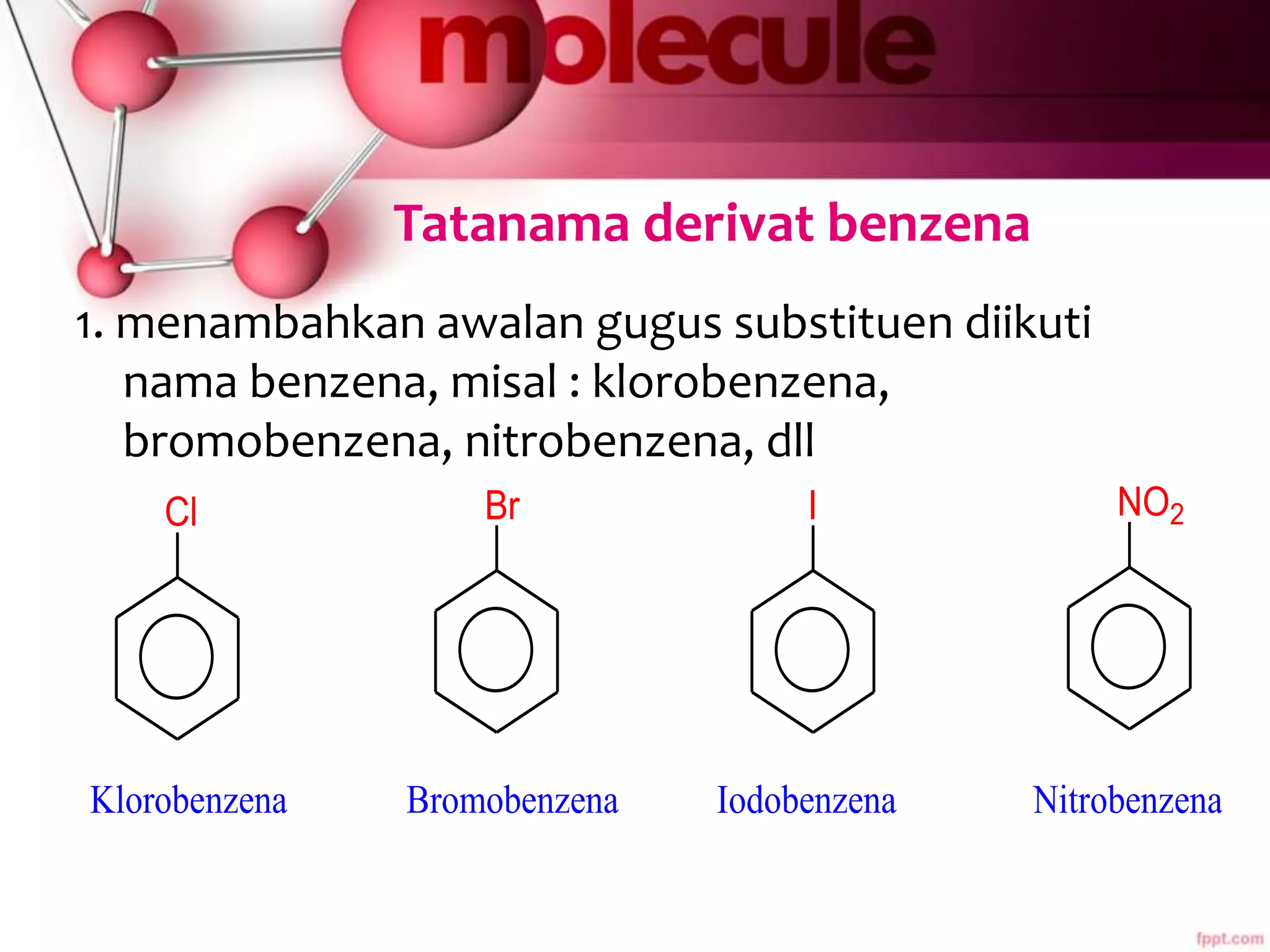
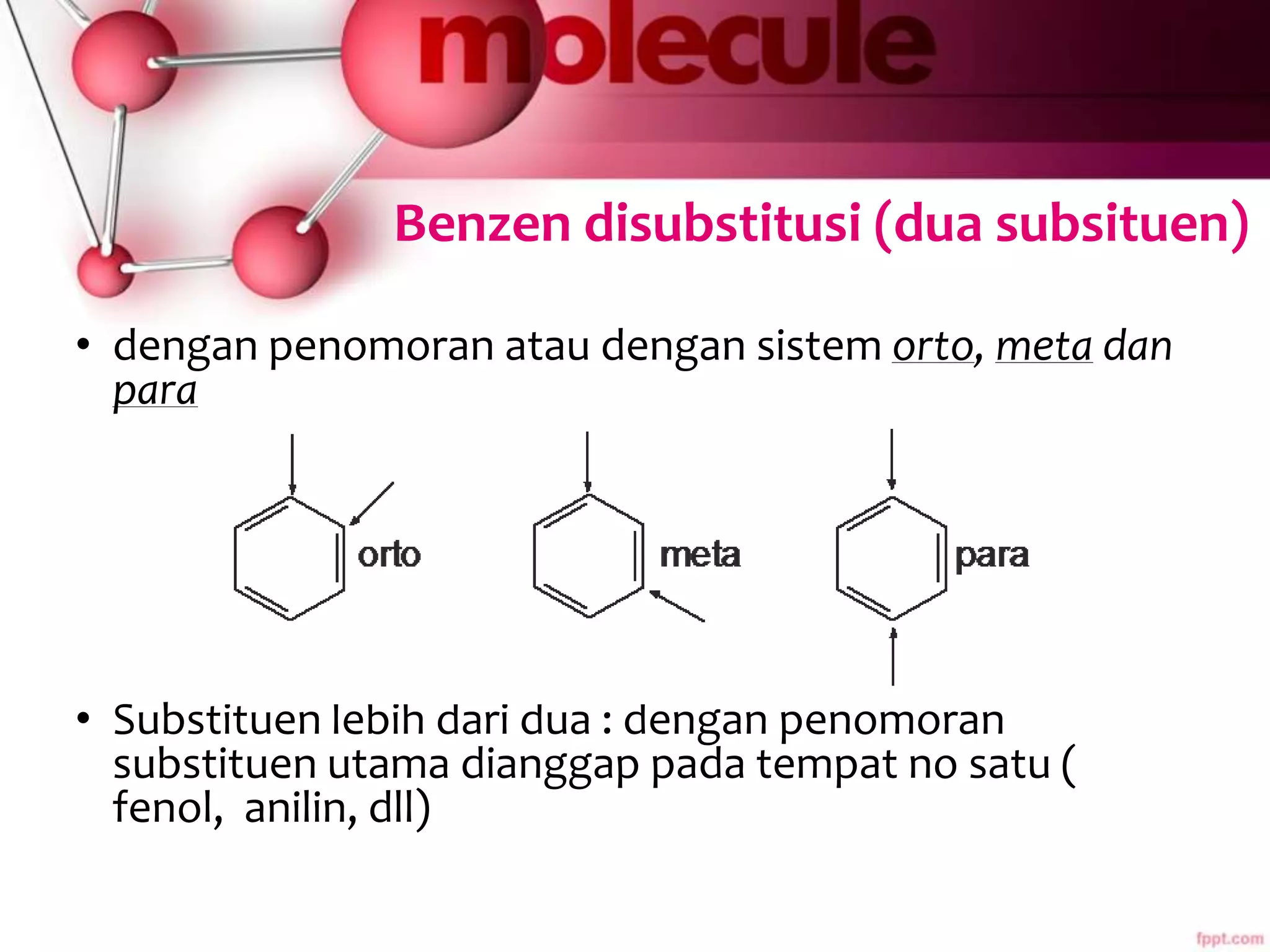
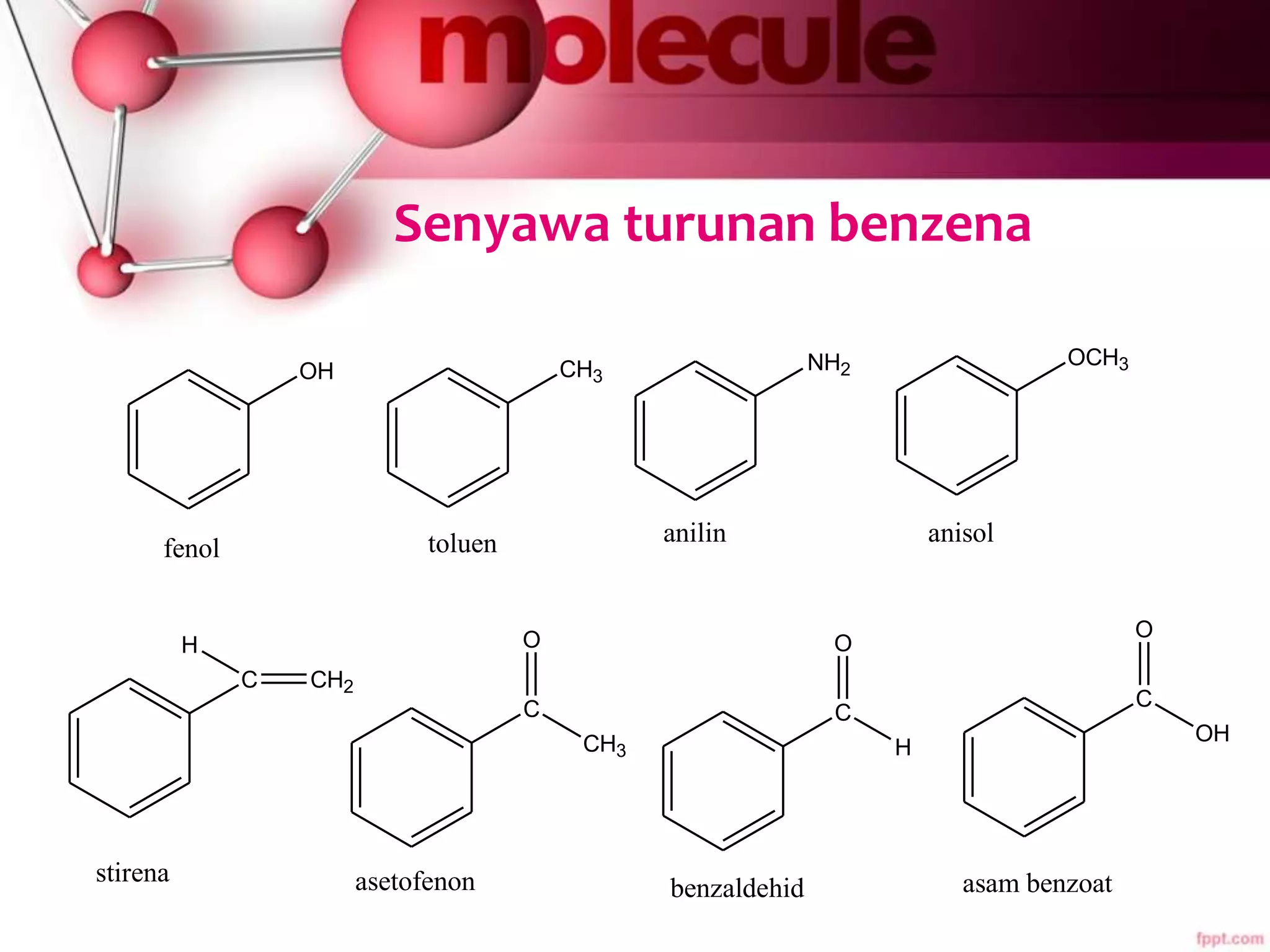
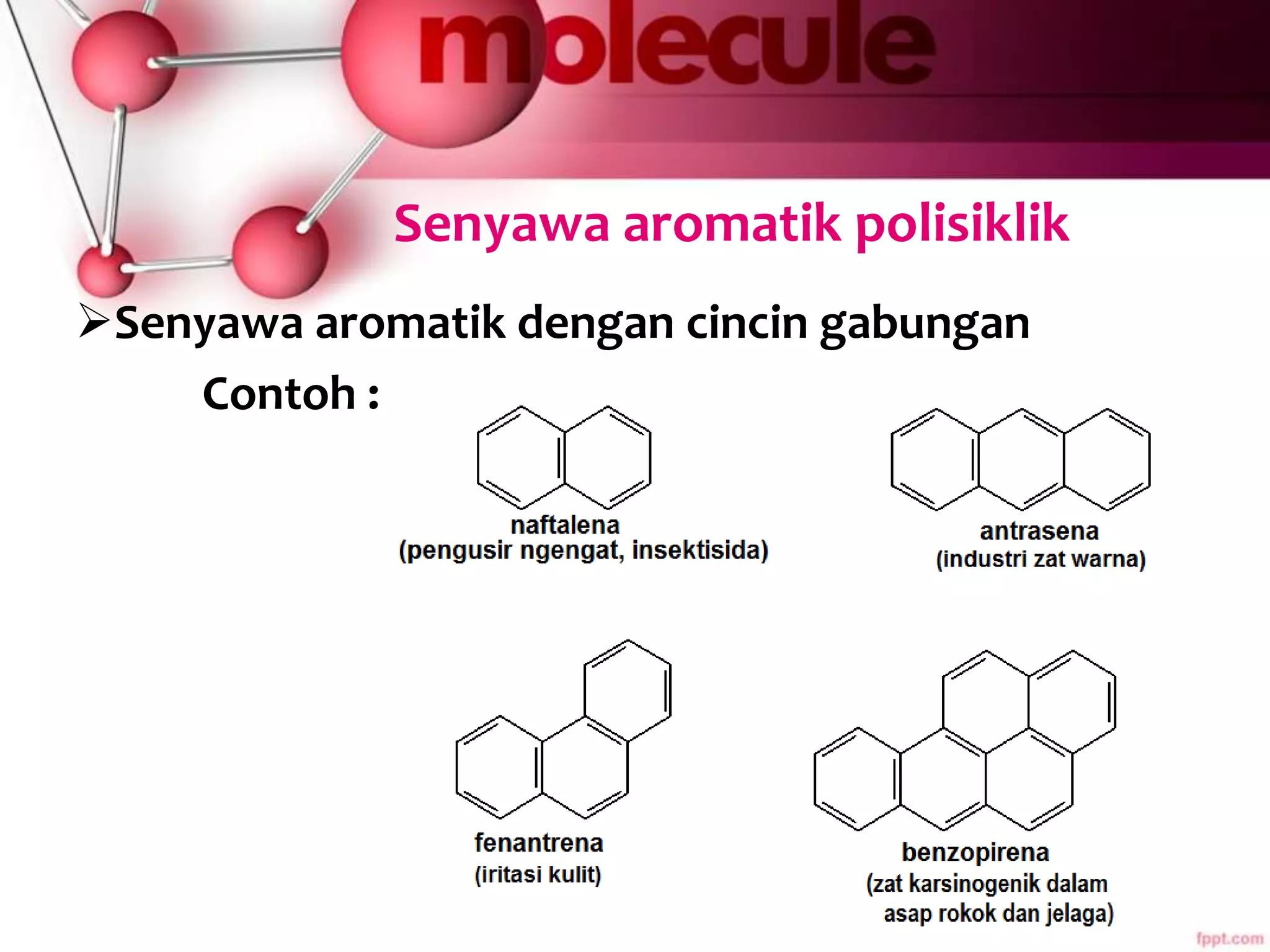
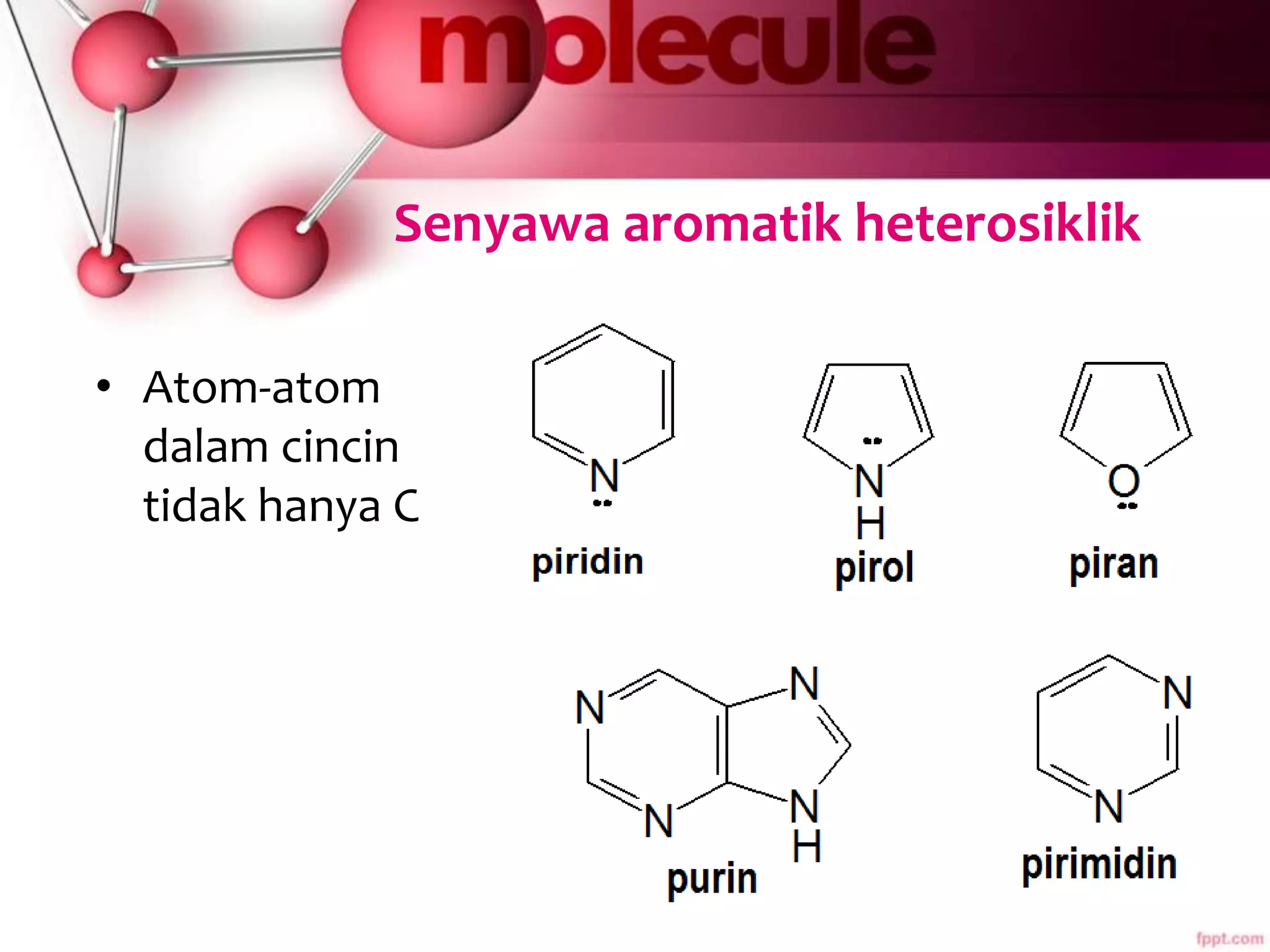
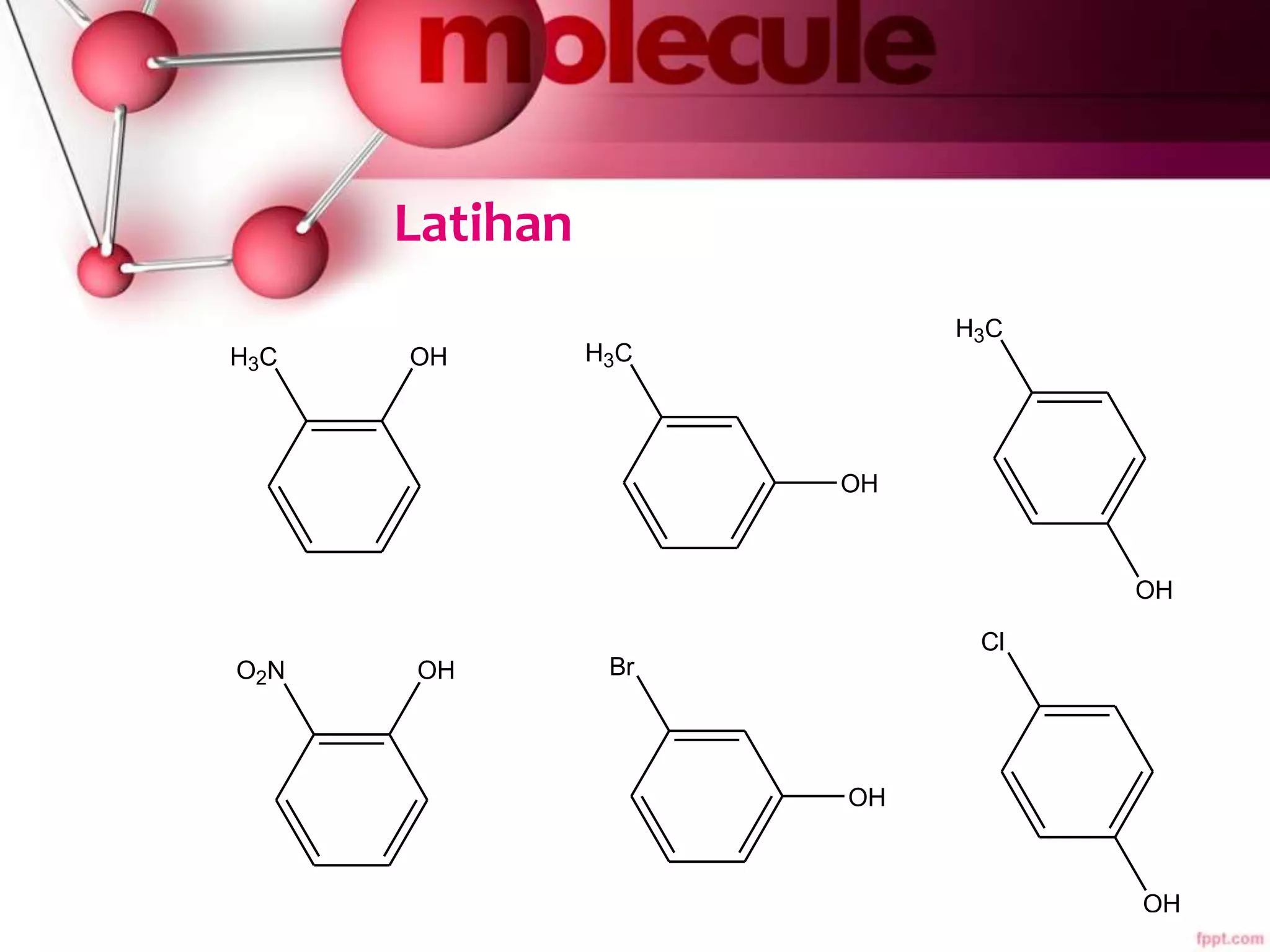
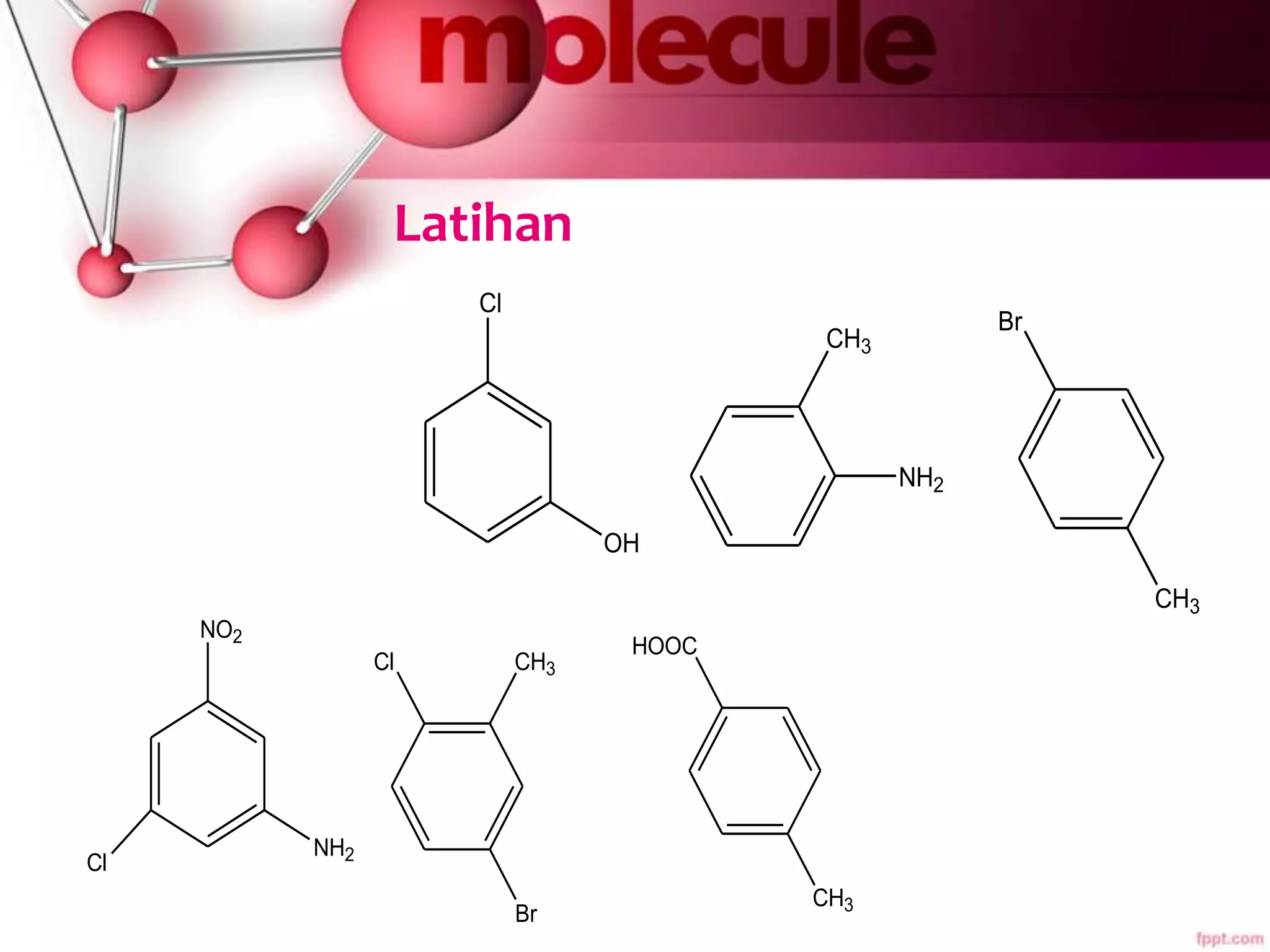
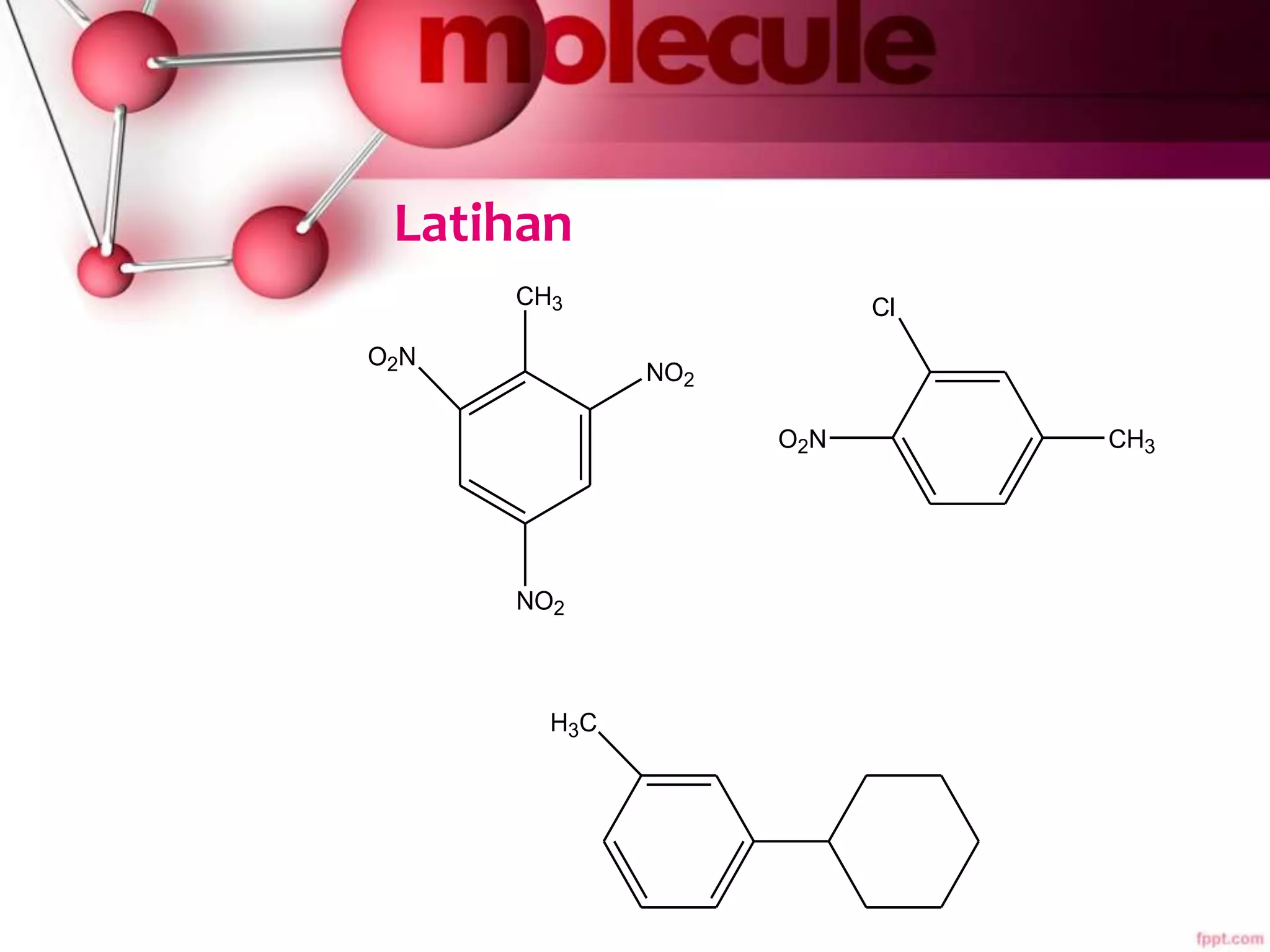
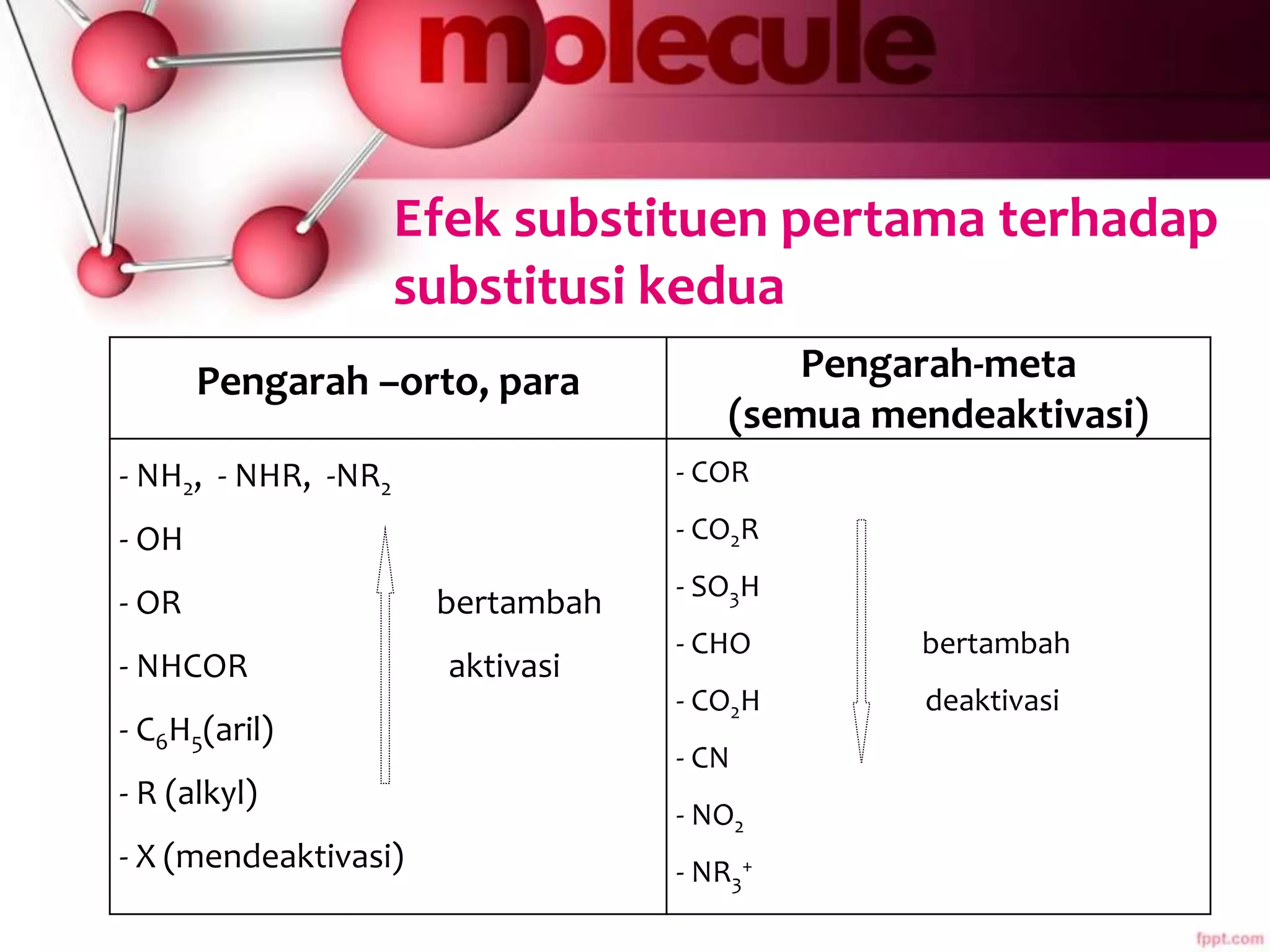
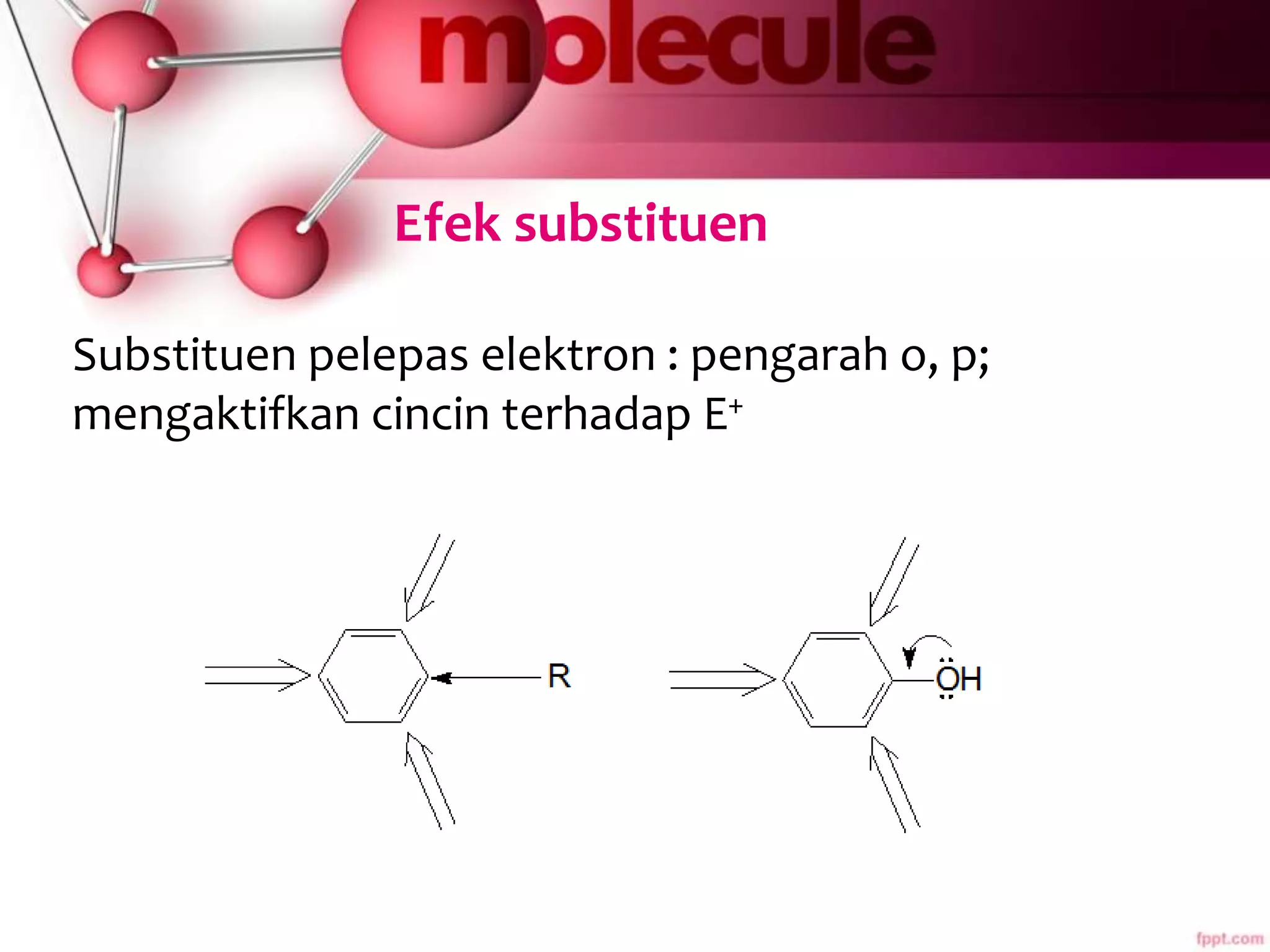
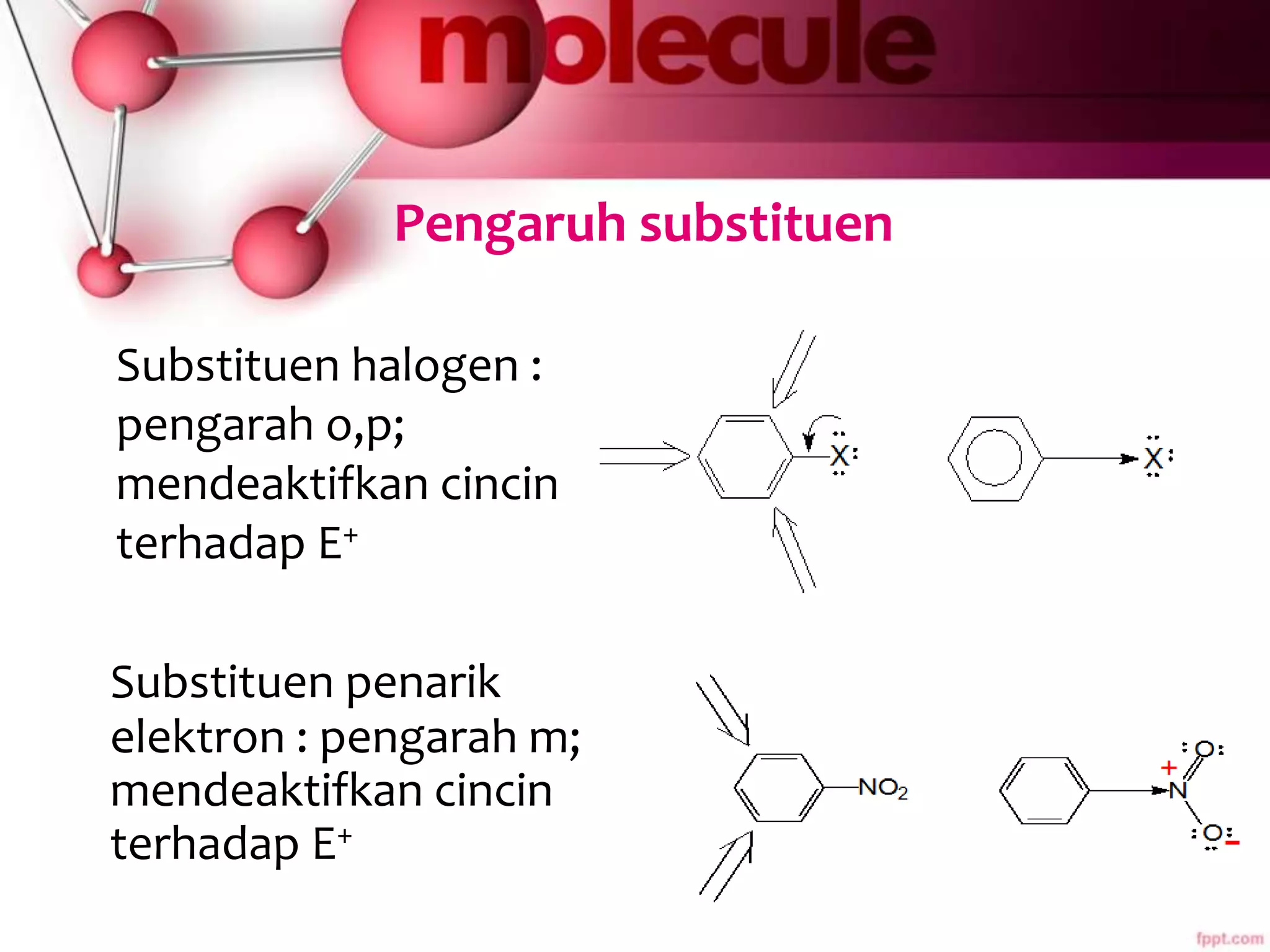
Dokumen ini membahas sifat-sifat dan struktur senyawa aromatik, terutama benzena, serta berbagai reaksi yang dapat terjadi pada senyawa tersebut, seperti halogenasi dan alkilasi. Selain itu, terdapat penjelasan mengenai tatanama derivat benzena dan sifat fisik-kimia senyawa aromatik. Efek substituen pada reaktivitas dan orientasi substitusi juga dijelaskan secara detail.