Recommended
PPTX
PDF
บทที่12 เชื้อเพลิงซากดึกดำบรรพ์และผลิตภัณฑ์
DOCX
แบบทดสอบปลายภาคเรียน วิทย์ 5 2558
PDF
เอกสารประกอบ เรื่อง สภาพสมดุลและสภาพยืดหยุ่น
PDF
บทที่ 20 ฟิสิกส์นิวเคลียร์ แก้ไขครั้งที่ 1
PDF
PDF
4 กฎรวมแก๊ส กฎแก๊สอุดมคติ
PDF
PDF
3 กฎของชาร์ล กฎของเกย์ลูสแซก
PDF
PDF
PPT
PDF
เอกสารประกอบบทเรียน เรื่อง งานและพลังงาน
PDF
PDF
การเปลี่ยนแปลงพลังงานและการเกิดปฏิกิริยาเคมี
PDF
PDF
PDF
PDF
แรงพยุงและหลักของอาร์คิมีดีส
PDF
PDF
โครงงาน เรื่อง การย้อมผ้าจากเปลือกมังคุด
PDF
2กฎของพาสคัล และหลักของอาร์คีมิดีส
PDF
PDF
กิจกรรมทางเศรษฐกิจของประเทศไทย
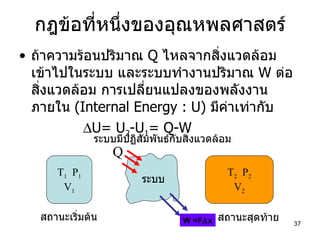
PDF
การคำนวณเกี่ยวกับสูตรเคมี
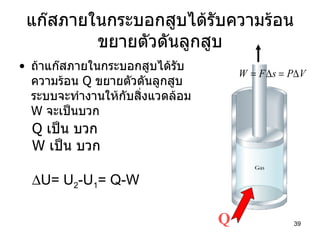
PPT
PDF
เอกสารประกอบการเรียน เคมีอินทรีย์ 1
PDF
6 ทฤษฎีจลน์และการแพร่ของแก๊ส
PDF
PPT
More Related Content
PPTX
PDF
บทที่12 เชื้อเพลิงซากดึกดำบรรพ์และผลิตภัณฑ์
DOCX
แบบทดสอบปลายภาคเรียน วิทย์ 5 2558
PDF
เอกสารประกอบ เรื่อง สภาพสมดุลและสภาพยืดหยุ่น
PDF
บทที่ 20 ฟิสิกส์นิวเคลียร์ แก้ไขครั้งที่ 1
PDF
PDF
4 กฎรวมแก๊ส กฎแก๊สอุดมคติ
PDF
What's hot
PDF
3 กฎของชาร์ล กฎของเกย์ลูสแซก
PDF
PDF
PPT
PDF
เอกสารประกอบบทเรียน เรื่อง งานและพลังงาน
PDF
PDF
การเปลี่ยนแปลงพลังงานและการเกิดปฏิกิริยาเคมี
PDF
PDF
PDF
PDF
แรงพยุงและหลักของอาร์คิมีดีส
PDF
PDF
โครงงาน เรื่อง การย้อมผ้าจากเปลือกมังคุด
PDF
2กฎของพาสคัล และหลักของอาร์คีมิดีส
PDF
PDF
กิจกรรมทางเศรษฐกิจของประเทศไทย
PDF
การคำนวณเกี่ยวกับสูตรเคมี
PPT
PDF
เอกสารประกอบการเรียน เคมีอินทรีย์ 1
PDF
6 ทฤษฎีจลน์และการแพร่ของแก๊ส
Similar to heat
PDF
PPT
PDF
10ความร้อนและทฤษฎีจลน์ของแก๊ส
PDF
PPTX
บทที่ 8 ความร้อนและอุณหพลศาสตร์
PDF
ความร้อนและทฤษฎีจลน์ของแก๊ส
PPTX
สื่อการสอน เรื่อง พลังงานความร้อน ม.1.pptx
PDF
PDF
PPTX
PPT
PDF
PPS
PDF
PDF
กฎทางอุณหพลศาสตร์ (Thermodynamic Laws)
PPTX
PDF
PDF
PPTX
PDF
5ความร้อน และการเปลี่ยนแปลงทางกายภาพ
More from Chakkrawut Mueangkhon
PDF
PDF
PDF
PDF
PPT
PPT
ตัวเก็บประจุและประจุไฟฟ้า
PPT
PPTX
PDF
DOC
PDF
PDF
PDF
PDF
PDF
PDF
DOC
PDF
PDF
PDF
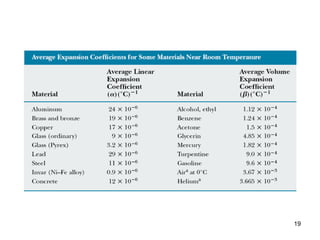
heat 1. 2-10 ความร้อน Slide นี้จัดทำตามเนื้อหาของ หนังสือเรียนสาระการเรียนรู้พื้นฐานและเพิ่มเติม ฟิสิกส์ เล่ม ๑ ของ สสวท . กระทรวงศึกษาธิการ เผยแพร่เพื่อประโยชน์ต่อสังคมโดยไม่หวังผลกำไรหรือประโยชน์ทางการค้าใดๆ สำหรับคุณครูใช้สอนศิษย์ และสำหรับนักเรียนใช้อ่านประกอบการเรียน ศรัณยู อังศุสิงห์ ( qlmtls@yahoo.co.th) 2. 3. 4. พลังงานความร้อน (Thermal Energy) มีหน่วยเป็นจูล (joule , J) ในระบบเอสไอ แต่หน่วยอื่นก็ยังนิยมใช้อยู่ เช่นแคลลอรี (Calorie,cal) Btu (British thermal unit) พลังงาน 1 แคลลอรี คือพลังงานความร้อนที่ทำให้น้ำที่มีมวล 1 กรัม มีอุณหภูมิสูงขึ้น 1 องศาเซลเซียส ( ในช่วง 14.5-15.5 องศาเซสเซียส ) พลังงาน 1 Btu คือพลังงานความร้อนที่ทำให้น้ำที่มีมวล 1 ปอนด์ มีอุณหภูมิสูงขึ้น 1 องศาฟาเรนไฮต์ ( ในช่วง 63-64 องศาฟาเรนไฮต์ ) 1 cal = 4.186 J 1 Btu = 252 cal = 1055 J 5. อุณหภูมิ (Temperature) การจะบอกว่าวัตถุร้อนมากหรือร้อนน้อยเราสามารถบอกได้ด้วยอุณหภูมิของวัตถุนั้น กรณีแก๊ส อุณหภูมิคือปริมาณที่แปรผันโดยตรงกับพลังงานจลน์เฉลี่ยของแก๊ส วัตถุที่มีระดับความร้อนมากจะมีอุณหภูมิสูง วัตถุที่มีระดับความร้อนน้อยจะมีอุณหภูมิต่ำ พลังงานความร้อยจะถ่ายโอนจากวัตถุที่มีอุณหภูมิสูงไปสู่วัตถุที่มีอุณหภูมิต่ำ จนกว่าวัตถุทั้งสองจะมีอุณหภูมิเท่ากัน 6. 7. สเกลองศาเซลเซียส ( Celsius , C) กำหนดว่าที่ความดัน 1 บรรยากาศ จุดเยือกแข็งของน้ำเป็น 0 องศาเซสเซียส และจุดเดือดของน้ำเป็น 100 องศาเซสเซียส ระยะระหว่างจุดเยือกแข็งถึงจุดเดือดแบ่งเป็น 100 ส่วนเท่าๆกัน การแปลงหน่วย C/5 =(F-32)/9 8. สเกลองศาเคลวิน ( Kelvin ,K) เป็นหน่วยของอุณหภูมิสัมบูรณ์ จึงไม่ต้องใช้คำว่าองศานำหน้าเคลวิน อุณหภูมิต่ำสุดคือ 0 เคลวิน ที่ความดัน 1 บรรยากาศ จุดเยือกแข็งของน้ำเป็น 273.16 K และจุดเดือดของน้ำเป็น 373.16 K ระยะระหว่างจุดเยือกแข็งถึงจุดเดือดแบ่งเป็น 100 ส่วนเท่าๆกัน 9. ความจุความร้อน (Heat Capacity) ถ้าให้พลังงานความร้อนน้อย ๆ Q จูลแก่สารมวล m กิโลกรัม ทำให้สารมีอุณหภูมิเพิ่มขึ้น T ความจุความร้อน C มีค่าเท่ากับ ความจุความร้อนคือความร้อนที่ทำให้สารนั้นมีอุณหภูมิสูงขึ้น 1 หน่วย ถ้าคิดสำหรับมวล 1 หน่วย เรียกว่า ความจุความร้อนจำเพาะ (specific heat capacity , c) ความจุความร้อนจำเพาะเป็นคุณสมบัติเฉพาะของสารแต่ละชนิด J/kg K 10. ตัวอย่าง 10.1 จงหาพลังงานความร้อนที่ทำให้เหล็กมวล 200 กรัม ที่อุณหภูมิ 20 องศาเซลเซียส มีอุณหภูมิสูงขึ้นเป็น 60 องศาเซลเซียส c ของเหล็ก = 450 J/kg K 11. ตัวอย่าง นักแข่งจักรยานมีน้ำหนักตัว 60 กิโลกรัมหนักขี่จักรยาน ออกแรงขี่จักรยานโดยก่อให้เกิดกำลัง 400 วัตต์ พลังงานนี้ 25 % ใช้ไปในการขับเคลื่อนรถจักรยาน อีก 75 % เป็นความร้อนในร่างกาย ถ้าความร้อนนี้ไม่มีการถ่ายเทให้กับสิ่งแวดล้อม นักแข่งจักรยานจะมีอุณหภูมิสูงขึ้นเท่าไรหลังขี่จักรยานได้ 1 ชั่วโมง ถ้าความร้อนจำเพาะของร่างกายคนเท่ากับ 3500 J/(kg.k) กำลังส่วนที่เป็นความร้อน = 0.75x400 = 300 W P=W/t W = Pt = 300x3600 = 1.1 x 10 6 J = Q Q = mc T T = Q/mc = 1.1 x 10 6 /(60)(3500) = 5. 2 K 12. สถานะและการเปลี่ยนสถานะของสาร สารมี 3 สถานะคือ ของแข็ง ของเหลว และแก๊ส การให้ความร้อนหรือการลดความร้อนทำให้สารเปลี่ยนสถานะ ในขณะที่สารเปลี่ยนสถานะ อุณหภูมิจะไม่เปลี่ยนแปลง ของแข็ง ของเหลว แก๊ส หลอมเหลว กลายเป็นไอ 13. 14. ความร้อนแฝงจำเพาะ (Latent Heat) ความร้อนแฝงจำเพาะของการหลอมเหลว (L m ) ของน้ำคือปริมาณความร้อนที่ทำให้น้ำแข็งอุณหภูมิ 0 องศาเซลเซียส จำนวน 1 กิโลกรัม หลอมเหลวหมด ที่ความดัน 1 บรรยากาศ ความร้อนแฝงจำเพาะของการกลายเป็นไอ (L v ) ของน้ำคือปริมาณความร้อนที่ทำให้น้ำอุณหภูมิ 100 องศาเซลเซียส จำนวน 1 กิโลกรัม กลายเป็นไอหมด ที่ความดัน 1 บรรยากาศ ถ้าเราทราบความร้อนแฝงจำเพาะของการเปลี่ยนสถานะของสารใด เราจะได้ว่าความร้อนที่ทำให้สารนั้นมวล m เปลี่ยนสถานะหมดคือ Q = mL 15. ตัวอย่าง 10.2 จงหาพลังงานความร้อนที่ทำให้น้ำแข็งมวล 250 กรัม อุณหภูมิ 0 องศาเซลเซียส ละลายกลายเป็นน้ำ และน้ำบางส่วนกลายเป็นไอ สุดท้ายเหลือน้ำในภาชนะ 240 กรัม ถ้าสำหรับน้ำ L m =333 kJ/kg L v =2256 kJ/kg c =4.2 kJ/kg K จาก Q = mL น้ำแข็งละลายหมด ต้องการความร้อน = (0.250 kg)(333 kJ/kg) = 83.25 kJ จาก Q = mc น้ำ 0 องศา กลายเป็นน้ำ 100 องศาใช้ความร้อน = (0.250 kg)(4.2 kJ/kg K )(100 K) = 105 kJ น้ำ 10 กรัม ที่ 100 องศาเดือดกลายเป็นไอใช้ความร้อน = (0.01 kg)(2256 kJ/kg) = 22.56 kJ พลังงานความร้อนทั้งหมดที่ต้องใช้ = 83.25 kJ + 105 kJ + 22.56 kJ = 210.8 kJ 16. การขยายตัวของวัตถุเนื่องจากความร้อน (Thermal Expansion วัตถุโดยทั่วไปเมื่อได้รับความร้อนจะขยายตัว ทำให้ความยาวหรือพื้นที่หน้าตัดหรือปริมาตรเพิ่มขึ้น ถ้าวัตถุเสียความร้อนวัตถุจะหดตัวทำให้ความยาวหรือพื้นที่หน้าตัดหรือปริมาตรลดลง การขยายตัวหรือหดตัวของของแข็งมีความสำคัญต่อการออกแบบทางวิศวกรรม เรานำคุณสมบัติของการขยายตัวหรืหดตัวของปรอทเมื่อได้รับหรือคายความร้อนมาสร้างเป็นเครื่องมือวัดอุณหภูมิ 17. Coefficient of linear expansion วัตถุชนิดหนึ่งเดิมมีความยาว L 0 เมื่ออุณหภูมิเปลี่ยนไป T พบว่าความยาวเปลี่ยนไป L L/L 0 = ค่าของ สำหรับวัสดุแต่ละชนิดไม่เท่ากันหาได้จาการเปิดตาราง 18. Coefficient of volume expansion วัตถุชนิดหนึ่งเดิมมีปริมาตร V0 เมื่ออุณหภูมิเปลี่ยนไป พบว่าความยาวเปลี่ยนไป V V V 0 ค่าของ สำหรับวัสดุแต่ละชนิดไม่เท่ากัน หาได้จาการเปิดตาราง 19. 20. 21. นำความรู้เรื่องการขยายตัวมาใช้ ความเค้น ความเครียด โมดุลัสของยัง โครงสร้างทางวิศวกรรมที่รับความร้อน แล้วมีความยาวเพิ่มขึ้น ถ้าโครงสร้างนั้น ถูกยึดไว้ไม่สามารถขยายตัวได้จะเกิดความ เค้นขึ้นในโครงสร้างนั้น เราสามารถคำนวน หาความเค้นนี้ได้ หาได้จากคุณสมบัติของ Thermal Expansion เปิดตาราง 22. 23. แก๊สอุดมคติ (ideal gas) สารในสถานะแก๊ส โมเลกุลทั้งหลายสามารถเคลื่อนที่ได้อย่างอิสระและฟุ้งกระจายเต็มภาชนะที่บรรจุ ปริมาตรของแก๊สขึ้นอยู่กับความดัน อุณหภูมิและมวลของแก๊ส สมการที่แสดงความสัมพันธ์ระหว่างปริมาตร ความดัน อุณหภูมิและมวลของแก๊สเรียกว่า กฎของแก๊ส 24. แก๊สแบ่งได้เป็น 3 ชนิดตามโครงสร้างของโมเลกุล แก๊สอะตอมเดี่ยว (monatomic gas) หนึ่งโมเลกุลของแก๊สชนิดนี้ประกอบด้วยอะตอมเพียงอะตอมเดียว เช่นแก๊สฮีเลียม (He) นีออน (Ne) อาร์กอน (Ar) เป็นต้น แก๊สอะตอมคู่ (diatomic gas) หนึ่งโมเลกุลของแก๊สชนิดนี้ประกอบด้วยอะตอม 2 อะตอม เช่น แก๊สไฮโดรเจน (H 2 ) ไนโตรเจน (N 2 ) ออกซิเจน (O 2 ) เป็นต้น แก๊สหลายอะตอม (polyatomic gas) หนึ่งโมเลกุลของแก๊สชนิดนี้ประกอบด้วยอะตอมตั้งแต่ 3 อะตอมเป็นต้นไป เช่น แก๊สโอโซน (O 3 ) มีเทน (CH 4 ) แอมโมเนีย (NH 3 ) เป็นต้น 25. เลขอโวกาโด (Avogadro s number N A ) คือจำนวนอะตอมของคาร์บอน 12 ซึ่งมีมวลรวมกันได้ 12 กรัมพอดี สารที่มีจำนวนโมเลกุลชนิดเดียวกันรวมกันได้เท่าจำนวนเลขอโวกาโด จะบัญญัติว่า เป็น 1 โมล (mole) N A = 6.02 x 10 23 ดังนั้นสาร 1 โมล มีโมเลกุลจำนวน 6.02 x 10 23 โมเลกุล 1 โมลของแก๊สไฮโดรเจนประกอบด้วยโมเลกุลของแก๊สไฮโดรเจนจำนวน 6.02 x 10 23 โมเลกุล 26. มวลโมลาร์ ( M ) มวลของแก๊สจำนวน 1 โมล เรียกว่า มวลโมลาร์ (M) ของแก๊ส ถ้า แก๊ส 1 โมเลกุล มีมวล = m M=mN A เช่น แก๊สออกซิเจนมีมวลโมลาร์เท่ากับ 32 g/mol หมายความว่าแก๊สออกซิเจนจำนวน 6.02 x 10 23 โมเลกุล จะมีมวลเท่ากับ 32 กรัม อากาศมีโมลโมลาร์เฉลี่ยเท่ากับ 28.9 g/mol 27. 28. 29. 30. 31. ให้ N เป็นจำนวนโมเลกุลของแก๊ส n = N/N A แทนลงในกฎของแก๊สจะได้ PV = (N/N A )RT ให้ R/N A = k B = Boltzmann constant k B = Boltzmann constant =8.31/6.02x10 23 = 1.38x10 -23 J/K ดังนั้นกฎของแก๊สอุดมคติ จึงสามารถเขียนได้อีกรูปแบบหนึ่งคือ PV = N k B T N เป็นจำนวนโมเลกุลทั้งหมดของแก๊ส 32. 33. แบบจำลองของแก๊สอุดมคติ แก๊สประกอบด้วยโมเลกุลจำนวนมาก ทุกโมเลกุลมีขนาดเท่ากัน มีความยืดหยุ่นสูง ดังนั้นโมเลกุลเหล่านี้จะชนผนังและกระดอนแบบยืดหยุ่นสมบูรณ์ ถือว่าปริมาตรรวมของทุกโมเลกุลน้อยมาก เมื่อเทียบกับปริมาตรของแก๊สทั้งภาชนะ จึงสามารถตัดปริมาตรของโมเลกุลทิ้งไปได้ ไม่มีแรงใดๆกระทำต่อโมเลกุลไม่ว่าจะเป็นแรงผลักหรือแรงดูด หรือแม้กระทั่งแรงโน้มถ่วงของโลกที่กระทำต่อโมเลกุลด้วย การเคลื่อนที่ของโมเลกุลเป็นแบบสุ่ม ซึ่งหมายถึงว่าโมเลกุลสามารถเคลื่อนที่ได้สะดวกทุกทิศทาง 34. จะได้ว่า แก๊สอุดมคติปริมาตร V โมเลกุล N ตัว พลังงานจลน์เฉลี่ยของการเคลื่อนที่ของแก๊สแปรผันกับอุณหภูมิเคลวิน พลังงานภายในระบบ (Internal Energy) U k B คือค่าคงที่ของโบลต์ซมันน์ = 1.38x10 -23 J/K 35. 36. กฎข้อที่ศูนย์ของอุณหพลศาสตร์ ถ้าวัตถุ A และวัตถุ B อยู่ในสภาวะสมดุลทางความร้อน และวัตถุ A กับวัตถุ C อยู่ในสภาวะสมดุลทางความร้อนแล้ว วัตถุ B และวัตถุ C ก็จะอยู่ในสภาวะสมดุลทางความร้อนด้วย กล่าวคือมีอุณหภูมิเท่ากันด้วย กฎข้อนี้มีนัยว่าอุณหภูมิเป็นคุณสมบัติที่มีอยู่จริง และอุณหภูมิเป็นปริมาณที่กำหนดว่าจะเกิดการไหลของความร้อนระหว่างระบบหรือไม่ A B Thermal Equilibrium T A =T C Q=0 A B T A > T C Q>0 Q 37. กฎข้อที่หนึ่งของอุณหพลศาสตร์ ถ้าความร้อนปริมาณ Q ไหลจากสิ่งแวดล้อมเข้าไปในระบบ และระบบทำงานปริมาณ W ต่อสิ่งแวดล้อม การเปลี่ยนแปลงของพลังงานภายใน (Internal Energy : U) มีค่าเท่ากับ U= U 2 -U 1 = Q-W T 1 P 1 V 1 T 2 P 2 V 2 Q W =F x สถานะเริ่มต้น สถานะสุดท้าย ระบบ ระบบมีปฏิสัมพันธ์กับสิ่งแวดล้อม 38. 39. 40. 41. 42. สรุปเครื่องหมายของ U , W, Q U พลังงานภายในระบบที่เพิ่มขึ้น + พลังงานภายในระบบที่ลดลง - W งานที่ทำโดยระบบ + งานที่ให้กับระบบ - Q ความร้อนเข้าสู่ระบบ + ความร้อนออกจากระบบ - 43.