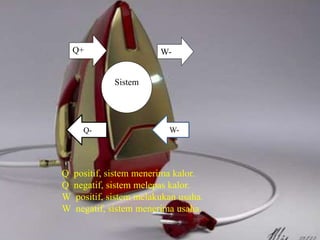
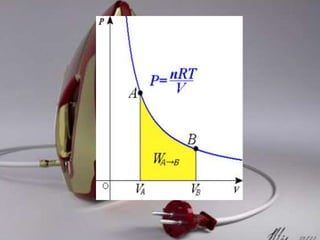
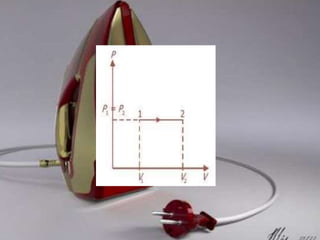
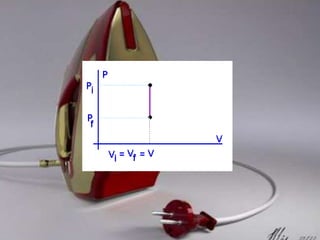
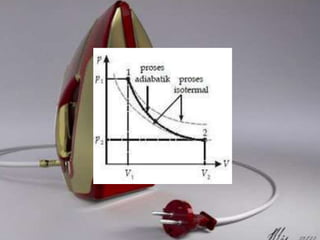
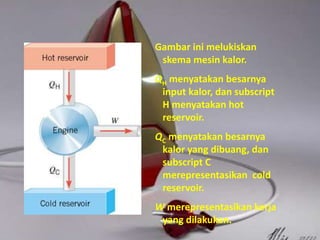
Dokumen tersebut membahas tentang termodinamika dan hukum-hukumnya. Kata "termodinamika" berasal dari bahasa Yunani yang berarti perubahan kalor dan dinamis. Hukum Pertama Termodinamika menyatakan bahwa perubahan energi dalam suatu sistem sama dengan selisih kalor dan kerja yang dilakukan sistem. Hukum Kedua menyatakan bahwa sebagian kalor tidak dapat diubah menjadi kerja melainkan a