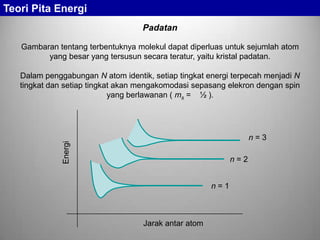
Teori Pita Energi menjelaskan tentang pembentukan tingkat-tingkat energi elektron pada atom, molekul, dan padatan. Ketika banyak atom bergabung membentuk padatan, tingkat valensi terluar setiap atom akan terpecah membentuk pita energi, sementara tingkat inti tidak terpecah. Pita energi ini dapat menentukan sifat konduktifitas suatu padatan, di mana konduktor memiliki pita valensi yang sebagian terisi dan beroverlap dengan p


![s p d f
5,143
4
5
6
7
2
3
4
5
67
3
4
5
6
7
3
4
5
6 7
4
5
6 7
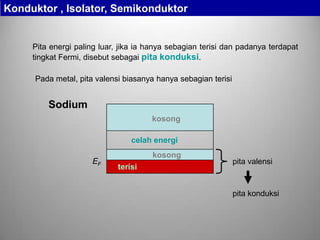
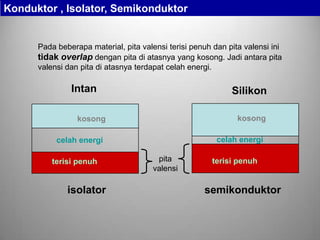
Sodium Hidrogen
E[eV]
0
1
2
3
4
5
6
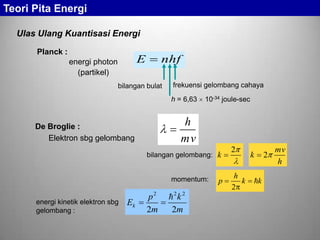
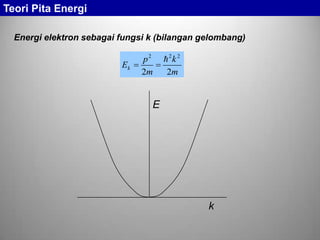
Kemungkinan terjadinya transisi elektron dari satu tingkat ke
tingkat yang lain semakin banyak
Teori Pita Energi
[6]](https://image.slidesharecdn.com/teori-pita-energi-130501223747-phpapp02/85/Teori-Pita-Energi-5-320.jpg)

![Penggabungan 2 atom H membentuk molekul H2
0
2
4
6
4
2
8
10
E[eV]
1 2 3
Ikatan stabil
Ikatan tak stabil
R0
Åjarak antar atom
Teori Pita Energi](https://image.slidesharecdn.com/teori-pita-energi-130501223747-phpapp02/85/Teori-Pita-Energi-7-320.jpg)

![0 5 10 15Å
10
20
30
0
E[eV]
sodium
2p
R0 = 3,67 Å
3s
3p
4s
3d
Teori Pita Energi
[6]](https://image.slidesharecdn.com/teori-pita-energi-130501223747-phpapp02/85/Teori-Pita-Energi-10-320.jpg)