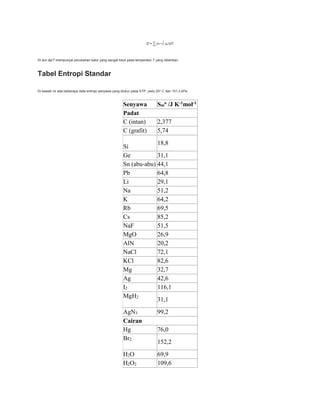
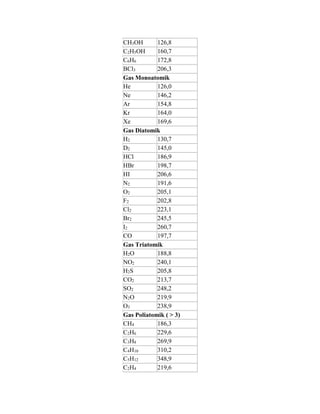
Entropi adalah ukuran ketidakteraturan suatu sistem, berbeda dengan energi. Entropi dapat dihitung menggunakan persamaan seperti S = k log W, ΔS = ΔQT, dan ΔS = Cln t2t1. Satuan entropi internasional adalah Joule per Kelvin. Tabel berisi data entropi standar berbagai senyawa dalam keadaan padat, cair, dan gas.