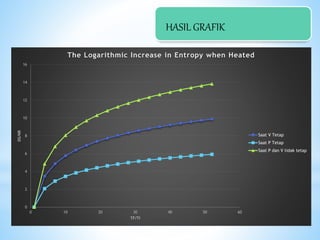
Dokumen ini membahas entropi dalam termodinamika, termasuk hukum-hukum dasar dan konsep energi bebas Gibbs. Hukum termodinamika kedua menyatakan bahwa perubahan spontan disertai dengan kenaikan entropi. Selain itu, dokumen juga menjelaskan cara menghitung perubahan entropi dalam berbagai proses termodinamika.