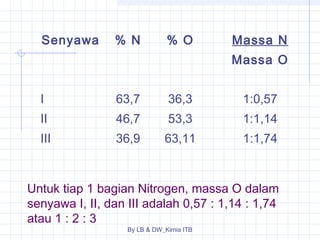
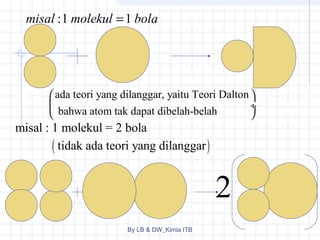
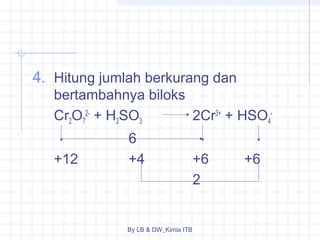
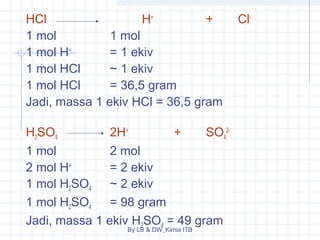
Dokumen tersebut membahas tentang stoikiometri, yang merupakan kajian hubungan kuantitatif dalam reaksi kimia. Dibahas pula beberapa hukum dasar kimia seperti hukum kekekalan massa, hukum perbandingan tetap, dan hukum kelipatan perbandingan. Selain itu, dibahas pula konsep-konsep seperti mol, rumus empiris, rumus molekul, dan penyetaraan persamaan reaksi.