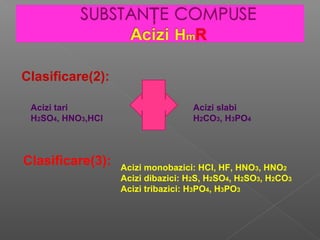
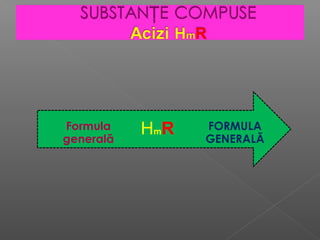
Acizii sunt substanțe chimice care conțin atomi de hidrogen și radicali acizi, fiind clasificați în hidracizi și oxiacizi. Acizii pot fi clasificați și după forța lor în acizi tari și acizi slabi, precum și după numărul de atomi de hidrogen în moleculele lor (monobazici, dibazici, tribazici). Obținerea acizilor se poate realiza prin reacții de combinare sau prin tratarea sărurilor cu acizi mai tari, iar proprietățile fizice ale acestor substanțe includ dizolvarea în apă și capacitatea de a conduce electricitatea.