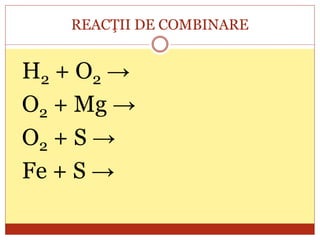
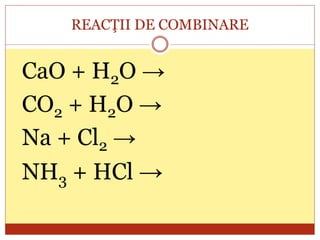
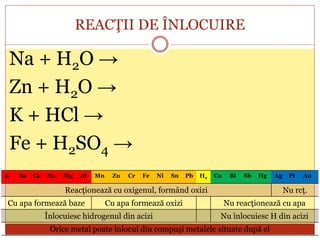
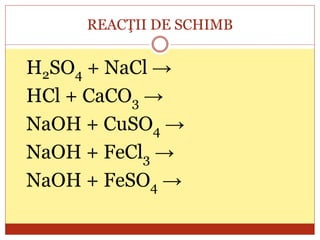
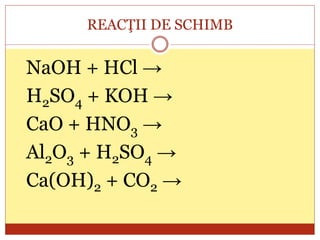
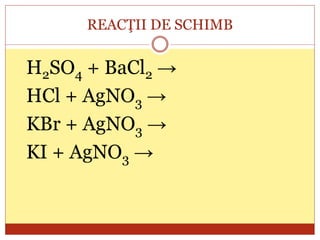
Documentul oferă o clasificare detaliată a reacțiilor chimice în funcție de mai multe criterii: modul de desfășurare (combinare, descompunere, înlocuire, schimb), schimbul de căldură (exoterme, endoterme) și viteza de desfășurare (rapidă, lentă). Fiecare tip de reacție este explicat prin exemple specifice, cum ar fi reacțiile de combinare care produc oxizi și reacțiile de descompunere care generează substanțe simple. În plus, se discută despre reactivitatea metalelor și despre reacțiile exoterme și endoterme, oferind o imagine cuprinzătoare asupra proceselor chimice fundamentale.