Recommended
PPTX
20170524 srws第三回pubmedを用いた系統的検索その1
PPTX
20160622 srws第五回risk of biasの評価
PPTX
20161222 srws第五回 Risk of Bias 2.0 toolを用いた文献評価
PPTX
滋賀医大Srws第三回Ovid Medline検索と文献管理
PPTX
20170305 srws robins i最終版
PPTX
PDF
PPT
PPTX
PPTX
201704 srws第一回preliminarysearching 一般公開
PPTX
PPTX
PDF
臨床疫学研究における傾向スコア分析の使い⽅ 〜観察研究における治療効果研究〜
PPTX
20161027 srws@kameda第二回系統的検索その1central
PPTX
PDF
PPTX
20170608 srws第四回pubmed検索その2
PPTX
PPTX
20160713 srws第六回後半、revmanでのメタ・アナリシス・ハンズオン
PDF
PPTX
201707srws第六回その3revmanでのメタ・アナリシス・ハンズオン
PPTX
20161023 srws第五回補足non rctのrob評価
PPTX
PPTX
20160713 srws第六回@メタ・アナリシス前半
PDF
PPTX
6.1メタアナリシス revman practice
PDF
PPTX
PPTX
201708 srws第八回 grade、prospero登録、PRISMA
PPTX
More Related Content
PPTX
20170524 srws第三回pubmedを用いた系統的検索その1
PPTX
20160622 srws第五回risk of biasの評価
PPTX
20161222 srws第五回 Risk of Bias 2.0 toolを用いた文献評価
PPTX
滋賀医大Srws第三回Ovid Medline検索と文献管理
PPTX
20170305 srws robins i最終版
PPTX
PDF
PPT
What's hot
PPTX
PPTX
201704 srws第一回preliminarysearching 一般公開
PPTX
PPTX
PDF
臨床疫学研究における傾向スコア分析の使い⽅ 〜観察研究における治療効果研究〜
PPTX
20161027 srws@kameda第二回系統的検索その1central
PPTX
PDF
PPTX
20170608 srws第四回pubmed検索その2
PPTX
PPTX
20160713 srws第六回後半、revmanでのメタ・アナリシス・ハンズオン
PDF
PPTX
201707srws第六回その3revmanでのメタ・アナリシス・ハンズオン
PPTX
20161023 srws第五回補足non rctのrob評価
PPTX
PPTX
20160713 srws第六回@メタ・アナリシス前半
PDF
PPTX
6.1メタアナリシス revman practice
PDF
PPTX
Viewers also liked
PPTX
201708 srws第八回 grade、prospero登録、PRISMA
PPTX
PPTX
PPTX
201708 srws第七回統合、層別・感度分析、欠測への対処
PPTX
20170610 AIと予測研究 slideshare
PPTX
Similar to 201708 srws第八回 sof、grade、prospero登録
PPTX
PPTX
20170202 srws第七回統合、層別・感度分析、欠測への対処
PPTX
PPTX
20160824srws第八回GRADE、PROSPERO、PRISMA
PDF
PDF
PDF
PPTX
20170223 srws第八回 sof、grade、prospero登録
DOCX
PDF
PPTX
PDF
PDF
ライブラリアンがGOBSATを阻止できるか考えてみた
PDF
PPTX
20170223 srws第八回 sof、grade、prospero登録
PPTX
20161015 srws第一回preliminarysearching 公開用
PPTX
PPTX
PPTX
PPTX
20160727 srws第七回@滋賀医大統合、層別・感度分析、欠測への対処
More from SR WS
PPTX
201707srws第六回その2メタアナリシス・異質性・出版バイアス
PPTX
PPTX
201707srws第六回その1メタ・アナリシスと存在、発生、効果の指標
PPTX
20170202 srws第7回補講RoB2.0で決める知りたい効果とは?
PPTX
PPTX
PPTX
20170120おおさかどまんなか原著論文 公開用
PPTX
20170212やっつけ仕事にしない「研究」ポートフォリオ 進行スライド1218
PDF
PPTX
冬期セミナーWS19簡単にアクセスできる臨床研究リソース
DOCX
PPTX
DOCX
冬期セミナーWS19臨床研究事前匿名化アンケートのまとめ
201708 srws第八回 sof、grade、prospero登録 1. 系統的レビュー研究計画書作成ワークショップ
第八回
GRADE / PROSPERO / PRISMA
尼崎総合医療センター Hospital Care Research Unit
片岡裕貴 辻本啓
京都大学大学院 辻本康
精治寮病院 阪野正大
岡山県精神科医療センター 宋龍平
京都大学大学院医学研究科社会健康医学系専攻医療疫学分野 吉岡貴史
安房地域医療センター 北本晋一
亀田総合病院集中治療科 佐藤明 山本良平 安田英人
近畿中央胸部疾患センター呼吸器内科 香川智子
亀田総合病院麻酔科 重城聡
亀田ファミリークリニック館山 宮本侑達
2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 高 High 真の効果が効果推定値に近いという
確信がある
中 Moderate 効果推定値に対し、中等度の確信が
ある。真の効果が効果推定値に近い
と考えられるが、大幅に異なる可能
性もある
低 Low 効果推定値に対する確信には限界が
ある。真の効果は効果推定値とは大
きく異なるかもしれない
非常に低 Very Low 効果推定値に対しほとんど確信がも
てない。真の効果は、効果推定値と
は大きく異なるものと考えられる
エビデンスの質は4段階
32
J Clin Epidemiol. 2011 Apr;64(4):401-6.
33. 34. 35. 研究の限界(risk of bias)
• アウトカムごとに評価する
• 質の高い研究と低い研究が混在する場合
は全体のエビデンスに与える影響を考慮
して評価する
ex) 脊髄損傷に対する介入Aの効果をみた研
究で、評価者の盲検化がされていなくても、
死亡というアウトカムはその影響が少ない。
一方、身体診察による運動機能評価では影
響が深刻
35
36. 37. 38. 39. 40. 非一貫性の例 含まれた研究が1つだけだったら?
40
Only one study (Study 2; 825 participants) provided
a report of the impact of treatment Z on quality of life
in people with syndrome Y.
This study found that Quality of Life scores at follow-
up were higher in the treatment Z group than in the
placebo group (MD 2.17 on the scale from 1 (very
dissatisfied) to 10 (very satisfied), 95% CI 1.20 to
3.91, p=0.01).
As this outcome was measured in only a single trial,
we couldn't assess the heterogeneity, so we
downgraded the quality of evidence by one level (to
moderate).
41. 42. 43. こんな場合は?
研究目的
The aim of the review was to explore
the effectiveness of treatment Z in
adult community-dwelling patients
with syndrome Y.
43
研究結果
Seven studies recruiting 1450 participants met the review
inclusion criteria. The studies recruited community-dwelling
people with severe syndrome Y who had a mean age of 70
years. In five of the included studies (Study 1, Study 3, Study
4, Study 5, Study 7) participants were 65 years or older.
44. 45. 46. 47. 48. 49. 50. 51. 52. 53. 54. 55. 56. 57. 58. 59. 60. 61. 62. 63. 64. 65. 66. 67. 68. 69. 70. 71. 72. 73. 74. 75. 76. 77. 78. 79. 80. 81. 82. 83. 84. 85. 86. 87. 88. 89. 89
Section and topic Item No Checklist item
ADMINISTRATIVE INFORMATION
Title:
Identification 1a Identify the report as a protocol of a systematic review
Update 1b If the protocol is for an update of a previous systematic review, identify as
such
Registration 2 If registered, provide the name of the registry (such as PROSPERO) and
registration number
Authors:
Contact 3a Provide name, institutional affiliation, e-mail address of all protocol authors;
provide physical mailing address of corresponding author
Contributions 3b Describe contributions of protocol authors and identify the guarantor of the
review
第8回
90. 90
Amendments 4 If the protocol represents an amendment of a previously completed or
published protocol, identify as such and list changes; otherwise, state plan for
documenting important protocol amendments
Support:
Sources 5a Indicate sources of financial or other support for the review
Sponsor 5b Provide name for the review funder and/or sponsor
Role of sponsor or
funder
5c Describe roles of funder(s), sponsor(s), and/or institution(s), if any, in
developing the protocol
第8回
91. 91
INTRODUCTION
Rationale 6 Describe the rationale for the review in the context of what is already known
Objectives 7 Provide an explicit statement of the question(s) the review will address with
reference to participants, interventions, comparators, and outcomes (PICO) 第1回
92. METHODS
Eligibility criteria 8 Specify the study characteristics (such as PICO, study design, setting, time
frame) and report characteristics (such as years considered, language,
publication status) to be used as criteria for eligibility for the review
Information sources 9 Describe all intended information sources (such as electronic databases,
contact with study authors, trial registers or other grey literature sources)
with planned dates of coverage
Search strategy 10 Present draft of search strategy to be used for at least one electronic
database, including planned limits, such that it could be repeated
Study records:
Data
management
11a Describe the mechanism(s) that will be used to manage records and data
throughout the review
Selection process 11b State the process that will be used for selecting studies (such as two
independent reviewers) through each phase of the review (that is, screening,
eligibility and inclusion in meta-analysis)
Data collection
process
11c Describe planned method of extracting data from reports (such as piloting
forms, done independently, in duplicate), any processes for obtaining and
confirming data from investigators
92
第2回
第3-4回
第3-4回
第3-4回
第3-4回
第3-4回
93. Data items 12 List and define all variables for which data will be sought (such as
PICO items, funding sources), any pre-planned data assumptions
and simplifications
Outcomes and prioritization 13 List and define all outcomes for which data will be sought, including
prioritization of main and additional outcomes, with rationale
Risk of bias in individual studies 14 Describe anticipated methods for assessing risk of bias of individual
studies, including whether this will be done at the outcome or study
level, or both; state how this information will be used in data
synthesis
Data synthesis 15a Describe criteria under which study data will be quantitatively
synthesised
15b If data are appropriate for quantitative synthesis, describe planned
summary measures, methods of handling data and methods of
combining data from studies, including any planned exploration of
consistency (such as I2, Kendall’s τ)
15c Describe any proposed additional analyses (such as sensitivity or
subgroup analyses, meta-regression)
15d If quantitative synthesis is not appropriate, describe the type of
summary planned
Meta-bias(es) 16 Specify any planned assessment of meta-bias(es) (such as
publication bias across studies, selective reporting within studies)
Confidence in cumulative evidence 17 Describe how the strength of the body of evidence will be assessed
(such as GRADE)
93
第6回
第2,8回
第5回
第6回
第6回
第7回
第7回
第6回
第8回
94. 95. 96. 97. Editor's Notes #2 いよいよ最終回です。 #4 メタアナリシスしないまとめかた
層別解析
感度解析
欠測への対処法について学びました。
結果を統合せず、それぞれの研究の結果の違いがどのような研究デザイン、対象、介入の違いで起きてくるのかを「表」にして医学的に分析する
層別解析 臨床的異質性の検討のために行う
感度分析 臨床的に 結論を補強するために、揺らぎがある仮定に対して、他の可能性について検討する。
欠測値への対処 決まったお作法があるのでそれに習う 実際やる際に辻本、片岡に相談 #5 まずはメタアナリシスしない場合の系統的レビューです。これについては単に組み入れられた研究の結果を表で示すだけです。これを質的な統合と呼びます。 #6 層別解析 臨床的異質性の検討のために行うものでした。
例えば、このハンバーガーを全体のメタアナリシスした結果とします。
層別解析は、右の図のように、バンズだけの結果はどうか、パテだけの結果はどうかとそれぞれのグループに分けて結果に違いが出るかを検討することを言います。
臨床的異質性があるかもしれないと思われるもの、例えば高齢者と若年者などに分けてみて、高齢者にのみ効果がある場合は、数値として異質性があるのではないかと推測することができます。
https://pixabay.com/ja/%E3%83%8F%E3%83%B3%E3%83%90%E3%83%BC%E3%82%AC%E3%83%BC-%E5%8E%B3%E3%81%97%E3%81%84%E5%B0%8B%E5%95%8F-%E8%89%AF%E3%81%84-%E3%83%9E%E3%83%83%E3%83%88-%E7%A9%BA%E8%85%B9-%E5%A4%8F-%E3%83%91%E3%83%B3-%E3%83%88%E3%83%9E%E3%83%88-813407/
https://ja.wikipedia.org/wiki/%E3%83%91%E3%83%86_(%E6%96%99%E7%90%86)#/media/File:Hamburger_od_spole%C4%8Dnosti_Hesburger,_vnit%C5%99ek.jpg #7 https://www.flickr.com/photos/westernareapower/16999770981
メタアナリシスを行うためには多くの仮定をおくことを学んだと思います。
例えば、欠測データを何らかの仮定のもとで補完していたりしますね。
でも、もし仮定が成り立っていなかったら?と考えると不安になります。
感度分析では、仮定している部分を外してみて、同じような結果が得られるかを検討します。
欠測データがある研究を除外して、全て追跡できた研究のみに絞ってみて、同じような結果が得られるかを見るといったことはよくやられています。
この感度分析により、メタアナリシスから出した結論をより強固なものにすることができます。 #8 層別解析ではいくつかの層に分けましたが、例えば高齢者ではどうだったか、若年者ではどうだったかというように、それぞれの結果に興味がありましたね。
一方、感度分析では通常対象を「限定」して、その結果が全体の結果と変わらないかに興味があります。
https://pixabay.com/ja/%E3%83%8F%E3%83%B3%E3%83%90%E3%83%BC%E3%82%AC%E3%83%BC-%E5%8E%B3%E3%81%97%E3%81%84%E5%B0%8B%E5%95%8F-%E8%89%AF%E3%81%84-%E3%83%9E%E3%83%83%E3%83%88-%E7%A9%BA%E8%85%B9-%E5%A4%8F-%E3%83%91%E3%83%B3-%E3%83%88%E3%83%9E%E3%83%88-813407/
https://ja.wikipedia.org/wiki/%E3%83%91%E3%83%86_(%E6%96%99%E7%90%86)#/media/File:Hamburger_od_spole%C4%8Dnosti_Hesburger,_vnit%C5%99ek.jpg #9 欠測への対処はお経なのでまた実際にやるときにご相談いただければと思います。
https://ja.wikipedia.org/wiki/%E8%88%AC%E8%8B%A5%E5%BF%83%E7%B5%8C #10 さて、本日のテーマはGRADE, PROSPERO, PRISMAです。
https://pixabay.com/ja/%E3%83%93%E3%82%B8%E3%83%8D%E3%82%B9-%E3%82%AB%E3%83%BC%E3%83%89-%E5%A5%91%E7%B4%84-%E3%83%97%E3%83%AC%E3%82%BC%E3%83%B3%E3%83%86%E3%83%BC%E3%82%B7%E3%83%A7%E3%83%B3-%E3%83%8D%E3%82%AF%E3%82%BF%E3%82%A4-%E3%83%93%E3%82%B8%E3%83%8D%E3%82%B9-1020067/ #11 ☆
#12 目標としては #13 ☆ #14 ☆ #15 私たちのワークショップが採用しているGRADEアプローチの考え方としては、研究ごとではなく、あくまでアウトカムごとに研究をまとめていくということをします。
http://aihara.la.coocan.jp/?tag=body-of-evidence #16 アウトカム毎にまとめるって、まだプロトコル書いてないしどんな研究がどんなアウトカムかわからないし、集めてから考えればいいんじゃない?と思う方もおられるかもしれません。
http://www.everystockphoto.com/photo.php?imageId=6620203&searchId=5cc6e4a036c1c698e83f35a3af67c4ee&npos=17 #17 果たしてそうでしょうか。
例えば、最初に出てきた糖尿病に対する減量手術を考えてみましょう。
この治療の重要なアウトカムにはどのようなものがあるでしょうか。
糖尿病の治癒、、、、などが挙げられるかと思います。
このように、どのようなアウトカムが臨床的に重要かは、医学的にかんがえる必要がある。
レビューチームに専門家が1人は必要なのはそのためです。 #19 https://www.flickr.com/photos/joelmontes/4343843789
系統的に調べても、重要なアウトカムが測られていないという事実は重大な発見です。
臨床医や患者など、医療に関する意思決定者にとって重要なアウトカムである場合には、そのアウトカムを レビュー計画段階に想定し、今から説明するSoF tableに含めておく必要があります。
繰り返しになりますが、測られたアウトカムをみて、SoFテーブルに含めるアウトカムを決定してはなりません。
http://www.grade-jpn.com/grade_pro-faq.html #20 かといって、全部を含めるのは無理な話かもしれません。
そのため一応、やっている中で重要なアウトカムが見つかった場合は、評価項目に含めてもよいとされました。
ただし、プロトコルから変更になったことを論文で明記しなければありません。
https://pixabay.com/ja/%E7%89%9B%E4%B9%B3-%E6%B6%B2%E4%BD%93-%E6%B5%81%E3%82%8C%E3%82%8B-%E6%B3%A8%E3%81%90-%E3%83%9C%E3%83%88%E3%83%AB-%E3%83%9B%E3%83%AF%E3%82%A4%E3%83%88-%E3%83%89%E3%83%AA%E3%83%B3%E3%82%AF-%E5%81%A5%E5%BA%B7-933106/
https://pixabay.com/ja/%E5%8B%95%E7%89%A9-%E7%8C%AB-%E3%81%8B%E3%82%8F%E3%81%84%E3%81%84-%E5%AE%B6%E7%95%9C%E5%8C%96%E3%81%95%E3%82%8C%E3%81%9F-%E7%9B%AE-%E9%A1%94-%E3%83%8D%E3%82%B3-%E6%AF%9B%E7%9A%AE-%E9%A0%AD-17430/ #21 http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
その規定したアウトカムをどのようにまとめていくかについてご説明します。
お示しした図ですと、
つまりこのテーブルで、ある介入が重要なアウトカムに対して、どれくらいの大きさがあるのか、そしてその効果量にどれくらい確信性があるのかが、わかるようになっています。
これが、エビデンステーブルと呼ばれるGRADEの中で最も重要な表になります。 #22 ☆ #23 GRADEの中で最も重要な表になります。
今日は考え方を
http://www.3news.co.nz/politics/call-for-an-overhaul-of-family-court-2014061513#axzz3fDdgWwMM #24 実際のGRADEアプローチは図の通りです。まずCQを設定し、推奨を決定するのに必要なSRとMAを行います。そしてどのくらいの効果がありどのくらいのエビデンスがあるのかを判断し、最終的には推奨するのかどうかおよびその程度を決定いたします。
今回のワークショップでは推奨を決定する前までのところを行います。一般的なSRの論文はここまでで、ガイドラインなどSRを元に推奨を決定する必要がある場合、さらなるステップを踏むことになります。 #25 ★エビデンステーブルに戻ります。 #26 http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
エビデンステーブルに戻ります。 #27 http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
アウトカムとして、all cause mortalityが挙げられています。 #28 http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
アウトカムとして、all cause mortalityが挙げられています。 #29 http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
アウトカムとして、all cause mortalityが挙げられています。 #30 別の言い方でご説明しますと、GRADEによって結果をまとめる際には再現可能性があるかどうかではなく、
評価した根拠、仮定を明示できるようにするということ、
そして先ほど2つに分かれていた、ある効果量とその効果の質を評価することが重要です。
エビデンスの質のGRADEの判断は判断者によって、ばらつくことがある
GRADEアプローチのガイドラインをメタアナリシスの結果出てきた効果量(アウトカムの数字の合算)だけまとめて 勉強会などでスライドにするのはエビデンスの評価という意味ではナンセンスかも (JSEPTICの血小板輸血ガイドラインのスライドなど)
http://www.jseptic.com/journal/jreview_187.pdf
→だから内的妥当性と外的妥当性が一緒に表記される Summary of findings table !! #31 エビデンスの質という言葉が何度も出てきていますが、これは #32 これはエビデンスの確実性とも呼ばれます。
効果サイズ、例えばRR3.0とかOR2.4とかいう数字が、将来的にどのくらい変わらなさそうか、その確からしさをエビデンスの質と呼んでいます。 #33 GRADEにおいてエビデンスの質は4段階に分かれています。
高、中、低、非常に低
さきほどから申し上げている、効果量について、今後覆ることがないであろうと結論づける確実性が強ければ強いほど高くなり、今後変わりそうであればあるほど、質は下がっていきます。
RCTはエビデンスの質を「高」から
観察研究は「低」から評価を開始する
#34 エビデンスレベルのつけ方については、RCTはエビデンスの質を「高」から
観察研究は「低」から評価を開始します。
#35 そしてこれらGRADEを下げる要因と上げる要因について評価を行い、4段階になっているレベルをスタート地点から動かしていきます。
次のスライドからは、これらのGRADEを上げる要因と下げる要因について詳しくみていきます。 #36 ★1つ目の研究の限界は第5回にお話ししたrisk of biasを用います。
質の高い研究と、、、
どういうことかというと、例えば 脊髄損傷に対して介入Aの効果を調べた研究では、盲検化の欠如による影響が死亡率の評価では深刻ではない。しかし、身体診察による運動機能評価であれば、深刻であるといえます。
このように、そのrisk of biasがどの程度エビデンスに影響するかを考え、GRADEを下げるかを決定します。
#37 続いて、データの非一貫性についてです。
これは結果に対する説明のつかない異質性のことを指します。
異質性というのは以前の講義でご説明しましたが、臨床的異質性、統計的異質性があります。
統計的異質性はフォレストプロットをみて、信頼区間の重なりはどうなのかを見たり、I統計量などを用いて、統計的にチェックしました。
異質性があるのですが、それがサブグループ解析などではよくわからなかった場合、メタアナリシスした結果は説明できない異質性があると言えます。(もちろん偶然かもしれません)
そのような場合、非一貫性があるとし、GRADEを下げることになります。
例えば、、
相原 守夫 診療ガイドラインのためのGRADEシステム
#38 ★第6回の復習になりますが、異質性を評価する上でIスクエアードを用いました。
例えばI2=35%というのは軽度〜中等度の異質性を指していました。 #43 続いてエビデンスの非直接性です。
これは外的妥当性とほぼ同様の意味だと考えていただいて結構です。
対象が狭すぎたり、介入が想定しているものと違っていたり、アウトカムが本当に知りたいものではなく代理アウトカムが使われていたりする場合があります。
例えば、BMI,,,, 減量手術,,,,, この場合はGRADEを下げることになります。
また、関節比較といって、実際にみたかったのはAとCの比較であったのに、AとB、 BとCの比較のみしかなく、それらをネットワークメタアナリシスという手法を用いて、AとCの比較に直している場合、非直接性となり、GRADEを下げることになります。
相原 守夫 診療ガイドラインのためのGRADEシステム
#46 ★
続いて、データの不正確さです。
ここは一番誤解の多いパートです。
統計解析的な知識を要するため、苦手な方は飛ばしていただいて、次の出版バイアスの説明に移ってください。
相原 守夫 診療ガイドラインのためのGRADEシステム
最適情報量の算出などについては今回の範囲をこえているので割愛します。
https://commons.wikimedia.org/wiki/File:Warning_icon.svg #47 そもそも、系統的レビューと診療ガイドラインで、エビデンスの質の定義が異なります。
系統的レビューでは先ほど申し上げたとおり、メタアナリシスして出てきた結果が正しいとどれくらい確信できるか?ということになります。
一方で、診療ガイドラインにおいては、治療を推奨するためには、ある程度以上の効果がないと推奨できませんね。その推奨をするのにどれくらい正しいと確信できるか?ということになります。 #48 メタアナリシスは複数の研究を合わせたものですが、それは理想的には1つのRCTだとみなすことができます。
そして、通常のRCT同様に、必要なサンプルサイズとイベント数を計算します。
さらに、サンプルサイズやイベント数を満たしておれば、信頼区間について判断します。 #49 このような考え方によって算出されるサンプルサイズとイベント数は別の言い方で、OISといいます。
OISを満たしておれば、信頼区間の幅が広いかどうかを判断します。
つまり、2段階の評価になります。 #54 どんなコントロール群のイベント発生割合でも400件以上のイベントがあれば十分と言えます。 #57 ★OISを満たしていたら、次は95%信頼区間を見ていきます。
#58 ★正解はBです。図で言うと縦から見たときに真の値が95%の確率で含まれる区間のことです。
目の前の研究の95%信頼区間の中に真の値があるかはわかりません。
#61 最後は出版バイアスです。
これはこの前にもお話ししましたね。
肯定的な、、、
みなさんがみているアウトカムが肯定的な研究のいいとこ取りで、よいという結果がでている可能性がある場合、具体的にはfunnel plotなどを検討した結果、出版バイアスがありそうだと判断された場合、GRADEを下げることになります。
否定的な研究の査読には時間がかかるなどのタイムラグバイアスも含んでいる
相原 守夫 診療ガイドラインのためのGRADEシステム
#62 例えば、私が研修医だった2010年頃にTNF阻害薬はリウマチ分野を含め適応をとっていましたし、実際に使われていました。
しかし、実はその時点で、、、
これは非常に大きな問題です。検索して出てきた論文の結果だけで、結論を出すと判断を誤ることがあるということです。 #63 これらのGRADEを下げる要因に深刻なものがないと判断されるとき、
https://pixabay.com/ja/%E5%AD%90-%E5%AD%90%E3%81%A9%E3%82%82-%E3%83%88%E3%83%B3%E3%83%8D%E3%83%AB-%E5%86%8D%E7%94%9F-%E6%A5%BD%E3%81%97%E3%81%84-698591/
GRADEを下げる要因で深刻なものがない場合に限ってGRADE をupする項目によりGRADE upを考慮する。 #64 初めて上げるということを検討します。
https://pixabay.com/ja/%E3%83%A6%E3%82%BF%E5%B7%9E-%E3%83%9E%E3%82%A6%E3%83%B3%E3%83%86%E3%83%B3-%E3%83%90%E3%82%A4%E3%82%AF-%E8%87%AA%E8%BB%A2%E8%BB%8A-%E3%83%9E%E3%82%A6%E3%83%B3%E3%83%86%E3%83%B3%E3%83%90%E3%82%A4%E3%82%AF-%E3%82%B9%E3%83%9D%E3%83%BC%E3%83%84-95032/ #65 GRADEを上げるのは、、、
相原 守夫 診療ガイドラインのためのGRADEシステム
RCTに対してはこれらの基準を用いてGRADEを上げる事はほぼない。 #66 効果の程度が大きい場合というのは、例えば,,,
この結果を受けて、いや、RCTでなく観察研究だから、うつ伏せ寝にしてはいけないとは言えないという価値判断をするでしょうか。
ほとんどは、うつ伏せ寝をやめようという判断になるのではないでしょうか。
前述のGRADEを下げる要因に深刻なものがなく、このように大きな効果が見られた場合、観察研究でもGRADEを上げてもよいと考えます。
SIDSの場合は1段階グレードアップ
ワルファリンの場合2段階グレードアップ
オッズはリスクより常に大げさな絶対値をとることに注意 #67 用量反応勾配というのは、
例えば
また、敗血症性ショックに対する抗菌薬投与のタイミングについてRQを立てたとして、
敗血症性ショック、、、
となると、強い因果関係が示唆されるのではないかということで、GRADEを上げるということになります。
ワルファリンの治療域を超えた抗凝固レベルが出血リスクを増加させるという確信性を高める
→1段階グレードアップ
抗生剤
時間と死亡率の用量反応勾配があり、死亡率への現実的かつ事実上の影響があるという確信性を高める
→1段階グレードアップ
#69 さて、もう一度エビデンステーブルを見てみましょう。
http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
そのルール従って評価した結果がこれです。
このテーブルの意味が分かるようになります。
まずは二つに分けましょう #70 それぞれ分割して見ていきます。
まず左側の部分です。
http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
そのルール従って評価した結果がこれです。
このテーブルの意味が分かるようになります。 #71 まずアウトカムがあり、
http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
そのルール従って評価した結果がこれです。
このテーブルの意味が分かるようになります。 #72 どういった研究が含まれるのか、数やフォローアップ期間
http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
そのルール従って評価した結果がこれです。
このテーブルの意味が分かるようになります。 #73 そして、risk of ,….といったエビデンスを下げる要因の評価があります。今回のケースはRCTを対象としているため、上げる要因については記載がありません。
http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
そのルール従って評価した結果がこれです。
このテーブルの意味が分かるようになります。 #74 これらの評価を総合的に考えて
http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
そのルール従って評価した結果がこれです。
このテーブルの意味が分かるようになります。 #75 エビデンスの質を決めます。
今回のケースですと、Moderateとなり、Highから下げた理由としては、非一貫性を挙げています。
http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
そのルール従って評価した結果がこれです。
このテーブルの意味が分かるようになります。 #76 さらに右に見ていくと、エビデンスの質がModerateに決まった横に、実際の効果量がどうだったかが、書いてあります。
エビデンスの
http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
そのルール従って評価した結果がこれです。
このテーブルの意味が分かるようになります。 #77 さらに右に見ていくと、エビデンスの質がModerateに決まった横に、実際の効果量がどうだったかが、書いてあります。
エビデンスの
http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
そのルール従って評価した結果がこれです。
このテーブルの意味が分かるようになります。 #78 実際の人数
エビデンスの
http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
そのルール従って評価した結果がこれです。
このテーブルの意味が分かるようになります。 #79 相対的な効果、relative effectが書いてあります。
エビデンスの
http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
そのルール従って評価した結果がこれです。
このテーブルの意味が分かるようになります。 #80 そして絶対的な効果、absolute effectが記載されています。通常1000人あたりどうだったかが記載されています。
エビデンスの
http://homepage3.nifty.com/aihara/EP_heparin_accp_aihara_20120426.html
そのルール従って評価した結果がこれです。
このテーブルの意味が分かるようになります。 #81 注目していただきたいのは、そのabsolute effectの下には、 #82 どれくらいの数のイベントを起こす集団であれば、 #83 どのくらいの効果があるか、それぞれ仮定し、計算して示されています。
これは、どういう患者さんに対して、この介入をした場合に、どれくらい効果が変わってくるのか、みなさん知りたいと思いますので、そういったところに対応する数字だと思って見ていただければと思います。
みなさんどうでしょうか。エビデンステーブルが少しは読めるようになったでしょうか。
できれば、みなさんが興味ある分野のエビデンステーブルを見ていただくと、さらに理解が深まるのではないかと思います。 #84 続いてプロスペロ登録についてお話ししたいと思います。
https://commons.wikimedia.org/wiki/File:Reichstag_queue_2.JPG #85 プロスペロとは、レビューを開始する前に、研究計画を登録するための、レジストリーです。
登録されたプロトコルは誰でもアクセスが可能となり、現在どんな系統的レビューがどのような計画で行われているのかチェックすることができます。
この登録の意義としては、
今からこんな研究をやるということを宣言する
これは、アウトカムをたくさん検定すると、多重検定によるアルファエラー、つまり偶然に有意差が出たものを誘発してしまいますので、それを避けるという意味
また、同じリサーチクエスチョンを持ったレビューを別々のグループが行うと、人的リソースが無駄になってしまいますので、それを減らすという意味もあります。
次に、論文を出した後に計画書と違うことをしていないか読者が確認できるという意味、これはアウトカム報告バイアスを防ぐという意味とも考えることができます。
さらに研究の進捗をチェックできるため、出版が遅れているものなどを見ることができます。
つまり、系統的レビュー自体の出版バイアスを見つけることもできます。
#86 やり方は簡単です。 #87 まずIDを作って、 #88 register reviewというボタンをクリックしていただければ、登録画面へ進みます。
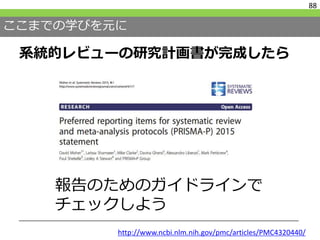
#89 さて、ここまで学んでいただいたことを全てまとめると、研究計画書はほぼ完成しています。
その研究計画書を報告するためのガイドラインが、PRISMA-Pです。
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4320440/
プロトコルが出来上がった段階で見直してみてください。
今回までの講義はこのガイドラインに沿って行いました。これまでの総復習となると思います。 #90 では何を報告すべきなのかということですが、
そのチェックリストを見ていくと、まず今回お話ししたregistrationがあります。
タイトル、オーサーというのは既に決まっていることだと思いますし、 #91 Amendmentsというのは、プロトコルと実際に行ったやり方に相違がある場合は報告するという、本日の内容です。
あとは資金源をどこからもらったのかもらっていないのかといったことを書きます。 #92 続いてイントロダクションには、研究の目的を書きましょうということですが、これは第1回にやってもらったことです。 #93 そしてMethodの部分です。
どういう患者を対象にするのか、どういうデータベースから検索してくるのか、どういう検索式を使うのか、
研究のデータをどういうふうに扱うのか、どういうふうに選び、どういうやり方でデータを抽出していくのかを書くとされています。
これは第2回から4回にかけてみなさんに学んでいただいたことだと思います。 #94 Methodの続きです。
抽出するデータは何なのか、アウトカムは何か、Risk of Biasはどうか、データの統合はどうやってやるのか、出版バイアスやアウトカム報告バイアスといったバイアスはどうか。
最後に、GRADEのような形でエビデンスを統合してまとめるということです。
これらについても既にご説明し、学んでいただきました。
この17のチェックリストを活用し、研究計画書を書く際には漏れのない報告を心がけてください。 #95 ☆ #96 ☆ #97 本日のおさらいです。
今日はGRADEの考え方の基本、特にエビデンスの質がどのように評価されているのかを学習しました。
PROSPERO登録のやり方・意義についても学習してもらいました。
そして、PRISMA-Pを使って、私たちの計画書に報告漏れがないかをチェックすることをお話ししました。
長期間に渡る講義、お疲れ様でした。
ここからは、みなさんが知りたいと感じていた疑問を実際にレビューして、世界へ発信してください。
#98 Cochrane handbook for Systematic Reviews of Interventions は書籍もあります。