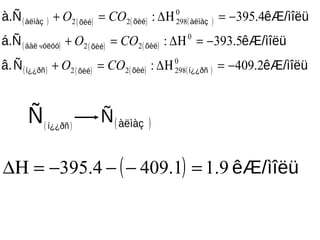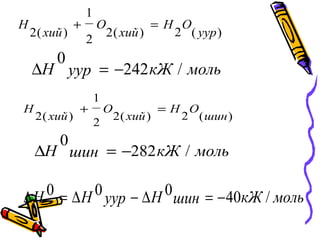More Related Content
PPTX
ODP
PPT
PPT
DOCX
DOC
DOCX
PPTX
What's hot
PPTX
PPTX
DOC
PPTX
DOCX
PPT
PPTX
PPT
PPT
DOCX
химийн тэнцвэр ба термодинамик үндэслэл ODP
PPTX
PPTX
ODP
PPTX
экосистемийн үндсэн ойлголт PPT
PPT
PPTX
PPTX
PPT
Viewers also liked
PPTX
PPT
PPT
DOCX
химийн термодинамикийн үндсүүд PPTX
PDF
Similar to 101 9-termohimiin vndes
DOCX
DOCX
DOC
DOC
DOCX
химийн термодинамикийн үндсүүд PPT
DOCX
физик химийн үүсэл хөгжлийн үндсэн чиглэл DOCX
физик химийн үүсэл хөгжлийн үндсэн чиглэл PDF
800.mn 2014 chemistry a by byambaa avirmed DOCX
DOC
PPT
ODP
PPTX
PPTX
PDF
PPT
DOCX
DOCX
PPT
More from Xaz Bit
PPT
PPT
PDF
PPTX
PPT
101 15-metalliin shinj chanar PPTX
PPTX
PPT
101 11-elektrolit ba bish PPT
PPT
101 8-himiin urbaliin hurd PPT
PPTX
PPT
101 3-organic bish angilal,nershil12 PPTX
101 9-termohimiin vndes
- 1.
- 2.
- 3.
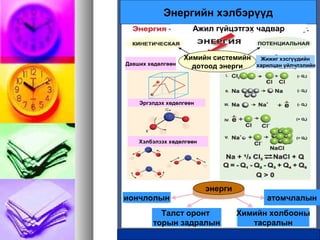
Энергийн хэлбэрүүд
Ажил гүйцэтгэхчадвар
Химийн системийн
дотоод энергиДавших хөдөлгөөн
Эргэлдэх хөдөлгөөн
Хэлбэлзэх хөдөлгөөн
энерги
иончлолын
Талст оронт
торын задралын
Химийн холбооны
тасралын
атомчлалын
Жижиг хэсгүүдийн
харилцан үйлчлэлийн
- 4.
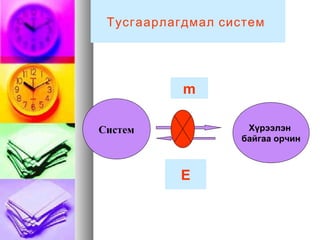
Дотоод энерги-Дотоод энерги-UU
химийн урвалын явцад гараххимийн урвалын явцад гарах
кинетик ба потенциалкинетик ба потенциал
энергийн өөрчлөлтийгэнергийн өөрчлөлтийг
тооцохгүйгээр системийн нийттооцохгүйгээр системийн нийт
энергийн өөрчлөлтийг дотоодэнергийн өөрчлөлтийг дотоод
энергийн өөрчлөлтөөр тооцожэнергийн өөрчлөлтөөр тооцож
болно.болно.
12 UUU −=∆
- 5.
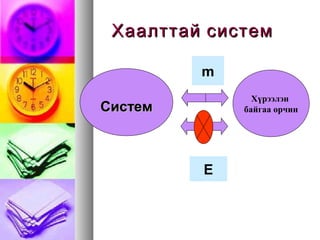
ДулаанДулаан--QQ
Нэг системийнжижигНэг системийн жижиг
хэсгийн давших, хэлбэлзэх бахэсгийн давших, хэлбэлзэх ба
эргэлдэх хөдөлгөөнөөрэргэлдэх хөдөлгөөнөөр
түүнтэй хиллэж байгаа өөртүүнтэй хиллэж байгаа өөр
нэг системийннэг системийн дотоод энергидотоод энерги
ихсэхихсэх үзэгдэлүзэгдэл
- 6.
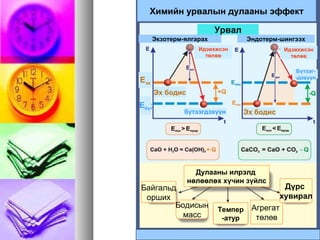
Химийн урвалын дулааныэффект
Урвал
Дулааны илрэлд
нөлөөлөх хүчин зүйлс
Бодисын
масс
Темпер
-атур
Агрегат
төлөв
Дүрс
хувирал
Байгальд
орших
Экзотерм-ялгарах Эндотерм-шингээх
Еэх
Ебүт
Эх бодис
Идэвхжсэн
төлөв
бүтээгдэхүүн Эх бодис
Бүтээг-
-дэхүүн
Идэвхжсэн
төлөв
- 7.
АжилАжил-А-А
Системийн жижигхэсгүүдСистемийн жижиг хэсгүүд
ххүрээлэнүрээлэн байбайггаа орчиндооаа орчиндоо
давших хөдөлгөөнийгдавших хөдөлгөөнийг
үүсгэн шилжих үедүүсгэн шилжих үед
явагдахявагдах дотоод энергийндотоод энергийн
өөрчлөлтөөрчлөлт
- 8.
- 9.
- 10.
- 11.
- 12.
- 13.
Химийн урвалынХимийн урвалын
дулааныилрэлдулааны илрэл-H-H
Экзотерм урвалын явцадЭкзотерм урвалын явцад
ялгарсан буюу эндотермялгарсан буюу эндотерм
урвалаар шингээсэнурвалаар шингээсэн
дулааны тоо хэмжээг угдулааны тоо хэмжээг уг
урвалынурвалын дулааны илрэлдулааны илрэл
- 14.
А. Дулаан ялгарууланявагдддаг :
Экзотерм
Б. Q шингээж явагддаг: Эндотерм
ìîëüê Æ/õèéõèÉõèé 9.29622
+=+ SOOS
êÆ/ìîëüõèéõàòóóõàòóó
23434
0
−+→ SOZnOZnSO t
- 15.
QQVV= ±= ±
QQРР=±= ± ∆H∆H
Гессийн хуульГессийн хууль ::
Оросын эрдэмтэнОросын эрдэмтэн
Г.И. Гесс 1940 ондГ.И. Гесс 1940 онд
термохимийн гол хуулийгтермохимийн гол хуулийг
дараах байдлаардараах байдлаар
томъёолжээтомъёолжээ..
U∆
- 16.
““ Химийн урвалынХимийнурвалын
дулааны илрэл ньдулааны илрэл нь
урвалыг явуулж байгааурвалыг явуулж байгаа
зам ба механизмаасзам ба механизмаас
хамаардаггүй харинхамаардаггүй харин
урвалд орж байгааурвалд орж байгаа
бодисын эхний төлөв бабодисын эхний төлөв ба
бүтээгдэхүүн бодисынбүтээгдэхүүн бодисын
эцсийн төлөвөөсэцсийн төлөвөөс
хамаарна”.хамаарна”.
- 17.
1.1. Химийн нэгдлийнүүсэхийнХимийн нэгдлийн үүсэхийн
дулаан:дулаан:
P=Const үед харгалзах данP=Const үед харгалзах дан
бодисоос нь 1 моль нэгдэлбодисоос нь 1 моль нэгдэл
үүсэхэд илэрч байгааүүсэхэд илэрч байгаа
дулааны хэмжээдулааны хэмжээ
54321 ∆Η+∆Η=∆Η+∆Η=∆Η
- 18.
1-р мөрдлөгөө:
Үүсэхийн дулаан:
∆Нх
0
=
2-р мөрдлөгөө:
∆Нх
0
=
( ) ( )∑∑ ∆Η−∆Η áîäèñýõ
¿¿ñ
á¿ò
¿¿ñ ,0,0
nn
( ) ( )∑∑ ∆Η−∆Η ¿íá¿òýýãäýõ¿
øàò
ýõ.áîäèñ
øàò ,0,0
nn
- 19.
- 20.
4-р мөрдлөгөө:
• Урвалдорж байгаа бодисуудын орших
төлөв ялгаатай боловч бүтээгдэхүүн
бодисууд нь нэгэн ижил төлөв үүсгэж
байгаа химийн 2 урвалын дулааны
илрэлийн ялгавар нь урвалын эхэнд
байсан бодис 1 төлвөөс нөгөө төлөвт
шилжихийн дулааны илрэлтэй тэнцүү
байна.
- 21.
( ) () ( ) ( )
( ) ( ) ( )
( ) ( ) ( ) ( ) êÆ/ìîëüÑâ.
êÆ/ìîëüá.Ñ
êÆ/ìîëüà.Ñ
í¿¿ðñõèéõèéí¿¿ðñ
õèéõèéóëóóáàë
àëìàçõèéõèéàëìàç
2.409:
5.393:
4.395:
0
29822
0
22
0
29822
−=∆Η=+
−=∆Η=+
−=∆Η=+
COO
COO
COO
ч
( )í¿¿ðñ
Ñ ( )àëìàçÑ
( ) ìîëüêÆ/9.11.4094.395 =−−−=∆Η
- 22.
5-р мөрдлөгөө:
Анхны төлөвнь ижил бодисуудаас
үүссэн нэгдлийн эцсийн төлөв нь өөр
өөр байх урвалын дулааны илрэл нь
бүтээгдэхүүн бодисын төгсгөлийн
1төлвөөс нөгөөд шилжих процессын
дулааны илрэлтэй тэнцүү.
- 23.