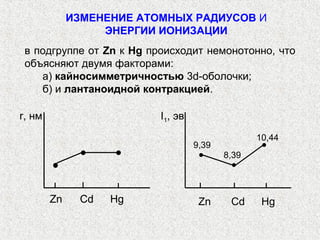
Документ содержит подробное описание химических свойств и поведения элементов группы IIB: цинка (Zn), кадмия (Cd) и ртути (Hg). Рассматриваются их атомные структуры, распространение в природе, физические свойства, методы получения, реакционная способность и образование соединений. Обсуждаются также характерные свойства и стабильность различных соединений этих элементов, включая их способность к комплексообразованию.







![ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Цинк в отличие от своих аналогов растворяется в
щелочах:
Zn + 2OH– + 2H2O = [Zn(OH)4]2– + H2↑
В щелочной среде стандартный электродный потен-
циал цинка значительно меньше стандартного
электродного потенциала водорода:
[Zn(OH)4]2– + 2e– = Zn + 4OH– ; E0 = –1,22 B
2H2O + 2e– = H2 + 2OH– ; E0 = –0,828 B
Для сравнения в щелочной среде E0Cd= –0,809 B,
а E0Hg = +0,10 B.](https://image.slidesharecdn.com/10iib-130124034054-phpapp01/85/10-iib-9-320.jpg)


![4 СОЕДИНЕНИЯ IIB-ЭЛЕМЕНТОВ
Оксиды и гидроксиды:
Оксид и гидроксид цинка амфотерны. Растворяются
как в кислотах, так и в щелочах:
Zn(OH)2 + 2H+ + 2H2O = [Zn(OH2)4]2+
Zn(OH)2 + 2OH– = [Zn(OH)4]2–
Производные иона ZnO22– (безводные цинкаты)
многих металлов могут быть получены сплавлением
ZnO с оксидами металлов:
BaO + ZnO = BaZnO2](https://image.slidesharecdn.com/10iib-130124034054-phpapp01/85/10-iib-12-320.jpg)
2
Cd(OH)2 + 6NH3 = [Cd(NH3)6](OH)2](https://image.slidesharecdn.com/10iib-130124034054-phpapp01/85/10-iib-13-320.jpg)




![4 СОЕДИНЕНИЯ IIB-ЭЛЕМЕНТОВ
Комплексные соединения:
Металлы IIB-группы проявляют гораздо большую
способность к комплексообразованию, чем IIА-
металлы. При растворении соединений Э(+2) в
воде, а также при взаимодействии ЭО или Э(ОН)2 с
кислотами образуются устойчивые аквакомплексы
типа [Э(ОН2)4]2+ и [Э(ОН2)6]2+.
Поэтому для Zn(+2), Cd(+2), Hg(+2) характерны
кристаллогидраты, например:
Zn(NO3)2∙6H2O; ZnSO4∙7H2O; Cd(NO3)2∙4H2O
Hg(NO3)2∙2H2O; Hg(ClO4)2∙6H2O
Устойчивы также аммиакаты [Э(NH3)4]2+ и [Э(NH3)6]2+
Э = Zn, Cd](https://image.slidesharecdn.com/10iib-130124034054-phpapp01/85/10-iib-18-320.jpg)
![4 СОЕДИНЕНИЯ IIB-ЭЛЕМЕНТОВ
Комплексные соединения:
Из анионных комплексов Э2+ наиболее прочны
комплексы с π-акцепторными лигандами типа CN–,
I–. Поэтому осадки Э(CN)2 и ЭI2 легко растворяются
в избытке основных цианидов и галогенидов:
Э(CN)2 + 2KCN = K2[Э(CN)4]
ЭI2 + 2KI = K2[ЭI4]
Таким же образом можно объяснить способность
HgS растворяться в растворах основных
сульфидов:
HgS + К2S = К2[HgS2]](https://image.slidesharecdn.com/10iib-130124034054-phpapp01/85/10-iib-19-320.jpg)

![ЗАДАЧИ И УПРАЖНЕНИЯ:
РЕШЕНИЕ:
Условие выпадения осадка:
[M2+]∙[S2–] > ПРMS
В насыщенном растворе сероводорода [H2S] = 0,13
моль/л. Концентрацию сульфид-ионов найдем из
выражения для константы равновесия:
H2S ↔ 2Н+ + S2–
[H+]2 [S2–]
К = ––––––––– = 6,0 10–22
[H2S]](https://image.slidesharecdn.com/10iib-130124034054-phpapp01/85/10-iib-21-320.jpg)
![ЗАДАЧИ И УПРАЖНЕНИЯ:
РЕШЕНИЕ:
К [H2S] 6,0 10–22∙ 0,13
[S2–]= –––––––––– = ––––––––––– = 3,1∙10–22
[H+]2 (0,5)2
[M2+]∙[S2–] = 1∙10–3∙3,1∙10–3 = 3,1∙10–25
ПРHgS = 4∙10–53 < 3,1∙10–25
ПРCdS = 1,2∙10–28 < 3,1∙10–25;
ПРFeS = 3,7∙10–19 > 3,1∙10–25
Решить самостоятельно. При каком значении рН
сульфид цинка не будет выпадать в осадок?
ПРZnS = 8∙10–26 .](https://image.slidesharecdn.com/10iib-130124034054-phpapp01/85/10-iib-22-320.jpg)