Документ описывает процесс комплексообразования, включая его основные принципы, теории, классификацию и номенклатуру комплексных соединений. Он объясняет роль лигандов и центральных атомов в формировании устойчивых частиц, а также охватывает такие понятия, как координационное число и дентатность. Также рассматриваются примеры, применение комплексных соединений, их устойчивость и методы описания через теорию валентных связей.
![ПРОСТЫЕ И КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
HF + BF3 → H [BF4]
CuSO4 + 4NH3 → [Cu(NH3)4] SO4
KNO2 + AgNO2 → K [Ag(NO2)2]
2KI + HgI2 → K2[HgI4]
Общая схема реакции комплексообразования:
Z–n
МZ+ + L‾ MLn
http://arkadiyzaharov.ru/studentu/chto-delat-studentam/neorganicheskaya-ximiya/](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-1-320.jpg)

![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Основные положения координационной теории
Центральный атом (ион), Лиганды
комплексообразователь
[ Co (NH3)6 ] Cl3
Внутренняя Внешняя
координационная координационная
сфера сфера
ХЛОРИД ГЕКСААММИНКОБАЛЬТА ( III )](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-3-320.jpg)



![ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Геометрическая (цис-транс) изомерия проявляется
для комплексов с разнородными, лигандами,
например, [Pt(NH3)2Cl4] и [Pt(NH3)2Cl2].
цис- изомер транс- изомер
(оранжевого цвета) (желтого цвета)](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-8-320.jpg)
![ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Соединения [Pt(NH3)2Cl2] — квадратный комплекс
также существуя в виде цис- и транс-изомера
цис-изомер транс-изомер
(оранжево-желтый) (светло-
желтый)](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-9-320.jpg)
![ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Координационная изомерия выражается в различной
координации двух типов лигандов относительно
двух разных комплексообразователей, например:
[Co(NH3)6][Cr(CN)6} [Cr(NH3)6][Co(CN)6]
Ионизационная изомерия проявляется в неоди-
наковом распределении анионов между внутренней
и внешней сферами, например, соединений состава
[CoBr(NH3)5]SО4 [CoSО4(NH3)5]Br
красно-фиолетовый красный
Из раствора изомера красно-фиолетового цвета не удается
осадить бромид-ионы Вг‾, но при действии ионами Ва2+
осаждается BaSО4. В растворе изомера красного иона,
наоборот, не удается осадить SО42- - ионы, но действием AgN03
осаждается бромид серебра AgBr.](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-10-320.jpg)
![ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Координационная изомерия выражается в различной
координации двух типов лигандов относительно
двух разных комплексообразователей, например:
[Co(NH3)6][Cr(CN)6} [Cr(NH3)6][Co(CN)6]
Ионизационная изомерия проявляется в неоди-
наковом распределении анионов между внутренней
и внешней сферами, например, соединений состава
[CoBr(NH3)5]SО4 [CoSО4(NH3)5]Br
красно-фиолетовый красный
Не удается осадить ионы Вг‾, Не удается осадить ионы SО42-,
но при действии ионами Ва2+ но действием AgNО3 осажда-
осаждается BaSО4. ется бромид серебра AgBr.](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-11-320.jpg)
![Классификация и номенклатура комплексов
1. Катионные комплексы
[Cu(H2O)4]Cl2 – хлорид тетрааквамеди ( II )
[Ag(NH3)2]NO3 – нитрат диамминсеребра ( I )
2. Анионные комплексы
K2[BeF4] – тетрафторобериллат ( II ) калия
Zn3[Fe(CN)6]2 – гексацианоферрат ( IV ) цинка
K2[PtCl6] – гексафтороплатинат ( IV ) калия
3. Нейтральные комплексы
[Pt(NH3)2Cl2] – дихлордиамминплатина
[Co(H2O)4(NO2)2] – динитротетрааквакобальт](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-12-320.jpg)
![КОМПЛЕКСООБРАЗОВАНИЕ
ЭЛЕКТРОСТАТИЧЕСКИЙ ПОДХОД
Ионы можно представить как заряженные шары,
силовые поля которых равномерно распределя-
ются во всех направлениях в пространстве:
– +
Pt4+ + 4Cl– → PtCl4 PtCl4 + 2Cl– → [PtCl6] 2–
O 2–
Cl– Cl–
Cl– Cl–
Cl– Pt4+ Cl– Pt4+
+ Cl –
Cl– Cl–
Cl– Cl–](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-13-320.jpg)
![КОМПЛЕКСООБРАЗОВАНИЕ _ ТЕОРИЯ ВС
Комплексное соединение – соединение, в котором имеется
хотя бы одна ковалентная связь, образованная по ДА-
механизму.
1. Обычный А• + •В → А В :
2. Донорно- :
А + □В → А В :
акцепторный
донор пары акцептор пары
электронов электронов
CuSO4 + 4NH3 → [Cu(NH3)4]SO4
сульфат аммиак сульфат
меди тетраамминмеди
2+ NH3 2+
□ ..
□ Cu □ + 4 :NH3 H3N : Cu : NH3
..
□
NH3](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-14-320.jpg)
![КОМПЛЕКСООБРАЗОВАНИЕ
УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ ИОНОВ
МZ+ + L– MLnZ–n
[ MLnZ–n ]
K уст =
[ МZ+] [ L– ]
Диссоциация:
1. K4[Fe(CN)6] = 4K+ + [Fe(CN)6]4–
2. [Fe(CN)6]4– Fe2+ + 6CN–
[Fe2+] [CN–] 6
K нест =
[Fe(CN)6]4–](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-15-320.jpg)
![УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
В РАСТВОРАХ
Образование и диссоциация комплекса MLn
происходят ступенчато:
[ML]
M+L ML K1 =
[M] [L]
[ML2]
ML + L ML2 K2 =
[ML][L]
[MLn]
MLn–1 + L MLn Kn =
[MLn–1] ∙[L]](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-16-320.jpg)
![УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
В РАСТВОРАХ
K уст = K1 ∙ K2 ∙ ∙ ∙ Kn
MLn Mn+ + nL–
1 [Mn+] [L]n
K нест = =
K уст [MLn]](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-17-320.jpg)






![ЗНАЧЕНИЯ КОНСТАНТЫ НЕСТОЙКОСТИ
НЕКОТОРЫХ КОМПЛЕКСОВ
1. [Ag(NO2)2]– Ag+ + 2NO2–
[Ag+] [NO2–]2
K нест = = 1,3 · 10–3
[Ag(NO2)2]–
2. [Ag(NH3)2]+ Ag+ + 2NH3
[Ag+] [NH3]2
K нест = = 6,8 · 10–8
[Ag(NH3)2]+](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-24-320.jpg)
![ЗНАЧЕНИЯ КОНСТАНТЫ НЕСТОЙКОСТИ
НЕКОТОРЫХ КОМПЛЕКСОВ
3. [Ag(S2O3)2]– Ag+ + 2S2O3–
[Ag+] [S2O3–]2
K нест = = 1 · 10–13
[Ag(S2O3)2]–
4. [Ag(CN)2]– Ag+ + 2CN–
[Ag+] [CN–]2
K нест = = 1 · 10–21
[Ag(CN)2]–](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-25-320.jpg)
![ОПИСАНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ С
ПОЗИЦИИ ТЕОРИИ ВАЛЕНТНЫХ СВЯЗЕЙ
Образование комплексов теория валентных связей
относит за счет донорно-акцепторного взаимодейст-
вия комплексообразователя и лигандов, Так,
образование тетраэдрического иона [BeF4]2- можно
объяснить следующим образом.
Ион Ве2+, имеющий свободные 2s- и 2p-орбитали,
является акцептором четырех электронных пар,
предоставляемых фторид-ионами:](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-26-320.jpg)
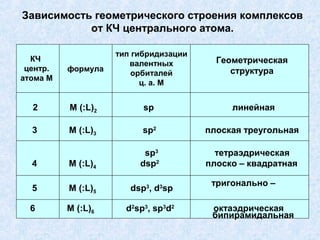
![ОПИСАНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ С
ПОЗИЦИИ ТЕОРИИ ВАЛЕНТНЫХ СВЯЗЕЙ
Ве2+ + 4:F‾
акцептор донор
Тетраэдрическое строение комплексного иона
[BeF4]2‾ обусловлено sр3 ‒_гибридизацией валентных
орбиталей бериллия.
Таким же образом можно показать, что при взаимо-
действии иона Cr3+ с молекулами воды образуется,
октаэдрический комплексный [Сг (OH2)6]3+ :](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-27-320.jpg)
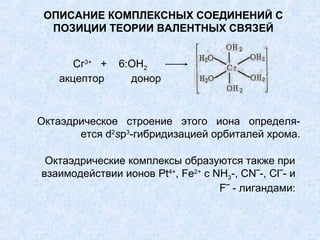
![КОМПЛЕКСООБРАЗОВАНИЕ
ТЕОРИЯ ВАЛЕНТНЫХ СВЯЗЕЙ
5d 6s 6p 6d
[Pt(NH3)6]4+
L L L L L L
3d 4s 4p 4d
[Fe(CN)6]4– L L L L L L
низкоспиновый
d2 sp3](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-29-320.jpg)
![КОМПЛЕКСООБРАЗОВАНИЕ В СВЕТЕ ТЕОРИИ ТВС
[PtCl6]2– Fe, Pt – d-элементы
[FeF6]4– … (n – 1) d1–10 ns2 np0 nd0
Pt 0 … 5d8 6s2 6p0 6d0
5d 6s 6p 6d
5d 6s 6p 6d
[PtCl6]2– L L L L L L
лиганды sp3d2 –октаэдр
[FeF6]4– 3d 4s 4p 4d
Fe 2+ … 3d6 4s0 4p0 4d0 L L L L L L
высокоспиновый
(внешнеорбитальный) лиганды](https://image.slidesharecdn.com/1-4-130124034035-phpapp02/85/1-4-30-320.jpg)