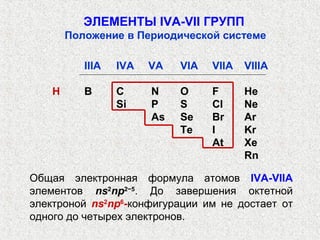
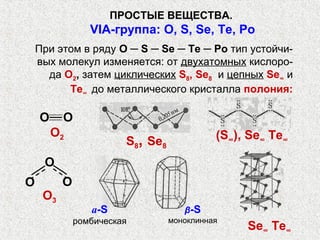
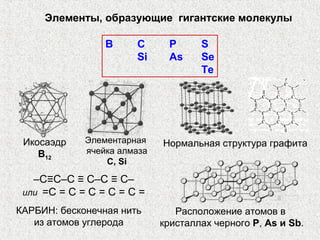
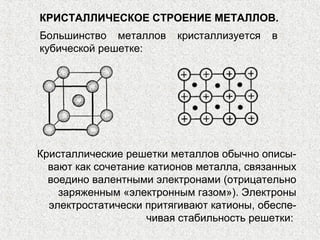
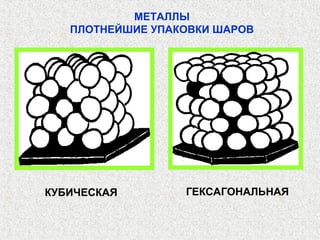
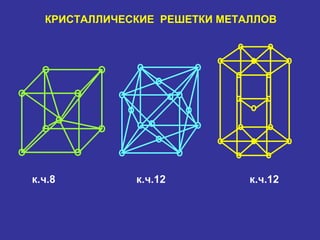
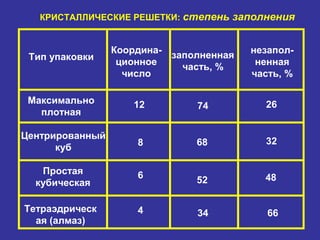
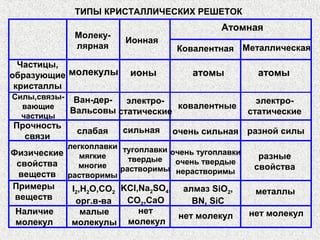
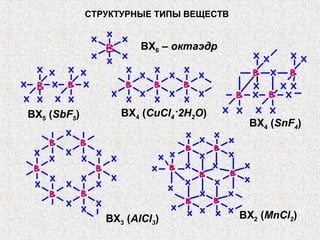
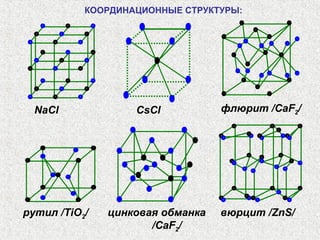
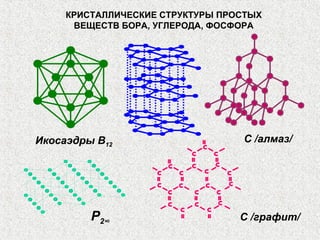
Документ рассматривает свойства простых веществ и соединений элементов групп IVA-VII, включая строение атомов, аллотропию и способы образования различных соединений. Описываются ковалентные и металлические связи, характеристики простых веществ, такие как температуры плавления и кипения, а также структуры кристаллических решеток металлов. Особое внимание уделяется электронному строению атомов, что влияет на их химические связи и физические свойства.