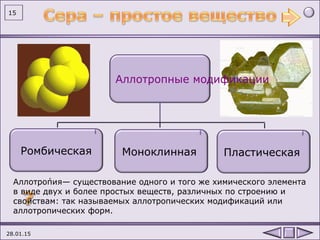
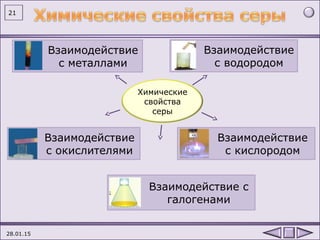
Документ содержит информацию о химическом элементе сере, включая его основные свойства, атомную структуру и способы получения. Также представлены химические реакции, в которых сера выступает как окислитель и восстановитель, а также ее использование в промышленности. Упомянуты аллотропные формы серы и ее химические свойства при взаимодействии с различными веществами.