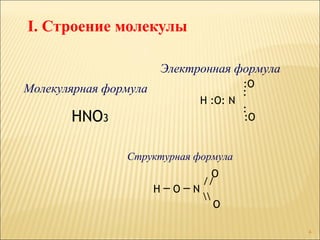
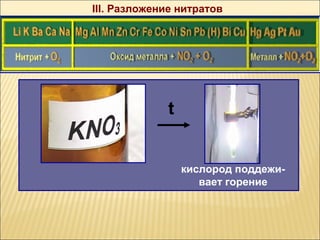
Документ описывает химические свойства азотной кислоты, включая ее структурные формулы, физические и химические свойства, а также правила обращения с ней. Рассматриваются реакционные характеристики с различными веществами, в том числе с металлами и основами, и приводятся примеры химических уравнений. Также упоминается процесс получения азотной кислоты как в лабораторных, так и промышленных условиях.