More Related Content
PDF
บทที่ 3 สมบัติของธาตุและสารประกอบ PDF
PPTX
PDF
แนวคิดเกี่ยวกับการเกิดปฏิกิริยาเคมี เล่ม3 PDF
เล่ม 5 ปฏิกิริยาเคมีในชีวิตประจำวัน PDF
PDF
PDF
แผนการจัดการเรียนรู้ที่ 9 อนุภาคในอะตอม.pdf What's hot
PDF
ใบความรู้เรื่องเซลล์ของสิ่งมีชีวิต1 PPTX
PDF
PDF
PDF
PDF
PDF
PDF
กล้องจุลทรรศน์ (Microscope) PDF
บทที่ 1 อะตอมและตารางธาตุ PDF
แบบทดสอบตามตัวชี้วัด ม.1.doc.pdf PPTX
เชื้อเพลิงซากดึกดำบรรพ์และผลิตภัณฑ์ 8 PDF
PPT
PDF
PDF
PDF
บทที่ 12 การสังเคราะห์แสง PDF
PDF
PPTX
PDF
Viewers also liked
PDF
แบบเรียน เรื่อง ฟิสิกส์นิวเคลียร์ PDF
เครื่องวัดรังสีสำหรับการป้องกันอันตรายจากรังสี PDF
บทที่ 20 ฟิสิกส์นิวเคลียร์ แก้ไขครั้งที่ 1 PDF
ความรู้เบื้องต้นเกี่ยวกับรังสี (Radiation Fundamental) PDF
PDF
Radiation Safety Instrument PDF
Similar to กัมมันตรังสี
PDF
PDF
PDF
PDF
เคมีนิวเคลียร์ (Nuclear Chemistry) PPTX
PPT
PPT
PDF
การใช้ประโยชน์จากวัสดุกัมมันตรังสีและวัสดุนิวเคลียร์ PDF
Radioactivity by piyaporn DOCX
แผนการจัดการเรียนรู้ ฟิสิกส์ 1 PDF
Determination of activity by piyaporn PDF
PDF
PDF
การสลายของธาตุกัมมันตรังสี PDF
PDF
summer 2010 (student preso) PDF
Ch103 part periodic table DOCX
PDF
PDF
More from kkrunuch
PDF
PDF
PDF
PDF
PDF
PDF
ส่วนประกอบของโปรแกรม Flie album PDF
เรื่องสารรอบตัว ครูเจริญ มีเหมือน PDF
PDF
ความหมายของระบบนิเวศ (Ecosystem) m3 PDF
การวิจารย์งานศิลปะและศิลปะตะวันออก ครูรัตติยา คำประชา กัมมันตรังสี
- 1.
- 2.
- 3.
- 4.
ในปี พ.ศ. 2439อองตวน อองรี
แบ็กเคอแรล เป็นคนแรกที่พบว่าธาตุบาง
ชนิดสามารถปล่อยรังสีออกมา ซึ่งพบโดย
บังเอิญ โดยเขานาฟิล์มถ่ายรูปมาไว้ใกล้ๆ
เกลือโพแทสเซียมยูเรนิลซัลเฟต และมี
กระดาษหุ้ม ปรากฏว่าเกิดรอยดาบนแผ่น
ฟิล์มเหมือนถูกแสง เขาให้เหตุผลว่า จะต้อง
มีรังสีพลังงานสูงบางอย่างปล่อยออกมาจาก
เกลือยูเรเนียมนี้
กัมมันตรังสี (Radioactivity)
- 5.
- 6.
ธาตุกัมมันตรังสี (radioactive element)
หมายถึงธาตุที่แผ่รังสีได้ เนื่องจากนิวเคลียสของอะตอมไม่เสถียรเป็น
ธาตุที่มีเลขอะตอมสูงกว่า 82
กัมมันตภาพรังสี
หมายถึง ปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง
การแผ่รังสี
จะทาให้เกิดธาตุใหม่ได้ หรืออาจเป็นธาตุเดิมแต่จานวนโปรตอนหรือ
นิวตรอนอาจไม่เท่ากับธาตุเดิม และธาตุกัมมันตรังสีแต่ละธาตุ มีระยะเวลาใน
การสลายตัวแตกต่างกันและแผ่รังสีได้แตกต่างกัน
กัมมันตรังสี (Radioactivity)
- 7.
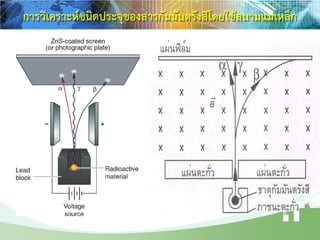
การสลายตัวของธาตุกัมมันตรังสี
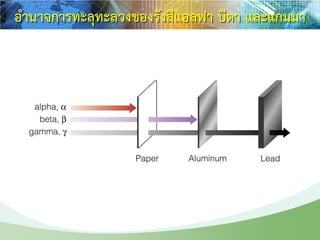
รังสีแอลฟา รังสีบีตา รังสีแกมมา
ab g
เป็นนิวเคลียสของฮีเลียมมี
โปรตอนและนิวตรอนอย่าง
ละ 2 อนุภาค มีประจุไฟฟ้า
+2 มีอานาจทะลุทะลวงต่า
มาก กระดาษเพียงแผ่นเดียว
หรือสองแผ่นก็สามารถกั้นได้
คือ อนุภาคที่มีสมบัติเหมือน
อิเล็กตรอน คือ มีประจุไฟฟ้า
-1 มีมวลเท่ากับอิเล็กตรอน
มีอานาจทะลุทะลวงสูงกว่า
รังสีแอลฟา
เป็นคลื่นแม่เหล็กไฟฟ้าที่มี
ความยาวคลื่นสั้นมาก ไม่มี
ประจุ ไม่มีมวล มีอานาจ
ทะลุทะลวงสูงสุด
- 8.
- 9.
- 10.
- 11.
- 12.
- 13.
- 14.
- 15.
- 16.
- 17.
- 18.
- 19.
- 20.
- 21.
- 22.
สมการนิวเคลียร์
สมการนิวเคลียร์ (Nuclear equation)
คือสมการที่แสดงปฏิกิริยานิวเคลียร์ สมการต้องดุลด้วย ซึ่ง
การดุลสมการนั้น ต้องดุลทั้งเลขมวล และเลขอะตอมทั้งด้านซ้ายและ
ขวาของสมการเคมีให้เท่ากัน กล่าวคือผลบวกของเลขมวลและเลข
อะตอมของสารตั้งต้นเท่ากับของผลิตภัณฑ์ ดังตัวอย่าง
- 23.
- 24.
- 25.
- 26.
- 27.
- 28.
- 29.
- 30.
- 31.
- 32.
- 33.
- 34.
- 35.
- 36.
- 37.
- 38.
- 39.
- 40.
- 41.
- 42.
- 43.
- 44.
- 45.
ตารางแสดง ปริมาณรังสีที่ร่างกายได้รับและอาการที่เกิดขึ้น
ปริมาณรังสี (เรม,rem) อาการ
0 – 25 ไม่ปรากฏอาการ
25 - 50 เกิดการเปลี่ยนแปลงในเม็ดเลือดขาว แต่ไม่ร้ายแรงมากนัก
50 – 200 มีอาการป่วยเนื่องจากรังสี
200 – 400 อาจถึงตายได้ถึง 50 เปอร์เซ็นต์
สูงกว่า 600 ตาย
เรม เป็นหน่วยวัดของปริมาณรังสีรวมเอาทั้งพลังงานและการรับปริมาณรังสี แล้วก่อเกิดผลทาง
ชีวภาพ (เรม, rem ย่อมาจาก roentgen เรินต์เกน แปลว่า man)
- 46.
- 47.
กากกัมมันตรังสี
คือ ของเสียไม่ว่าอยู่ในรูปของของแข็ง ของเหลวหรือ
ก๊าซ ที่ประกอบหรือปนเปื้อน ด้วยสารกัมมันตรังสี ในระดับ
ความแรงรังสีสูงกว่าเกณฑ์กาหนดว่าเป็นอันตราย และวัสดุ
นั้นๆ ไม่เป็นประโยชน์อีกต่อไปแล้ว กากกัมมันตรังสีหรือของ
เสียเหล่านั้นจะต้องได้รับการบาบัดและดาเนินการอย่างมี
ระบบและผ่านการตรวจสอบอย่างเคร่งครัด
กากกัมมันตรังสี
- 48.
- 49.
- 50.
- 51.
- 52.
- 53.
- 54.
- 55.
- 56.
- 57.
- 58.
- 59.
ครึ่งชีวิต (half life)
ครึ่งชีวิต(half life) ของสารกัมมันตรังสี
หมายถึง ระยะเวลาที่นิวเคลียสของธาตุกัมมันตรังสีสลายตัวจน
เหลือเพียงครึ่งหนึ่งของปริมาณเดิม ใช้สัญลักษณ์เป็น t1/2
- 60.
- 61.
- 62.
ครึ่งชีวิต (half life)
ตัวอย่างธาตุกัมมันตรังสีมีครึ่งชีวิต 30 วัน จะใช้เวลานานเท่าใดสาหรับการ
สลายไปร้อยละ 75 ของปริมาณตอนที่เริ่มต้น
ถ้าเริ่มต้นมีธาตุกัมมันตรังสีอยู่ 100 g สลายตัวไป 75 g
ดังนั้นต้องการให้เหลือธาตุนี้ 25 g
เนื่องจากธาตุนี้มีครึ่งชีวิต 30 วัน
ธาตุกัมมันตรังสี 100 g 50 g 25 g30 วัน 30 วัน
ดังนั้นต้องใช้เวลา 30 x 2 = 60 วัน สาหรับการสลายไป
ร้อยละ 75 ของปริมาณเริ่มต้น