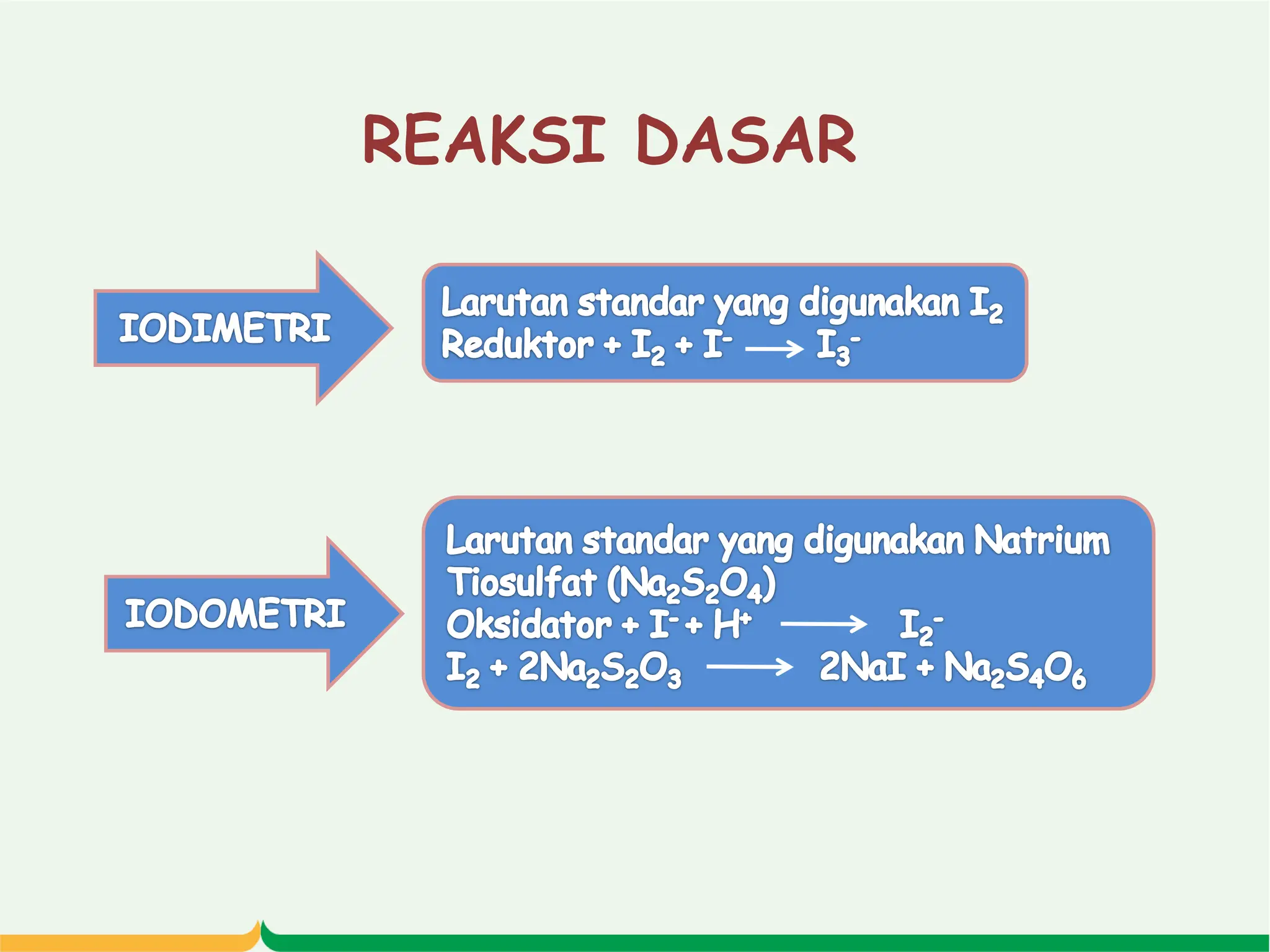
Dokumen ini menjelaskan tentang titrasi iodimetri, termasuk definisi, prosedur, dan aplikasi dalam penentuan kadar vitamin C. Terdapat informasi mengenai standarisasi larutan iodin, penggunaan indikator amilum, serta keuntungan dan kerugian dari metode ini. Selain itu, disertakan penjelasan mengenai reaksi dan perhitungan yang diperlukan dalam titrasi iodimetri dan iodometri.