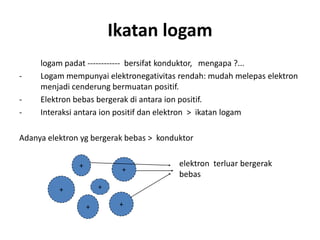
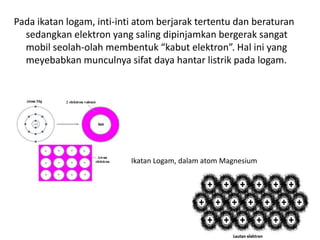
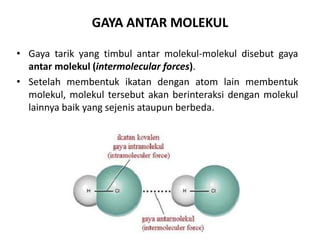
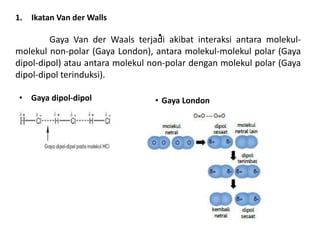
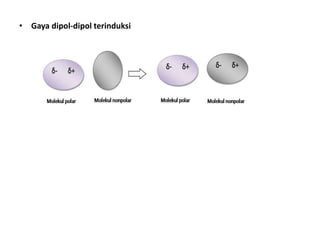
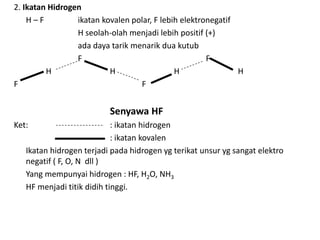
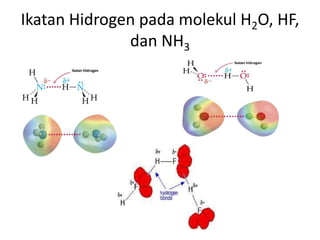
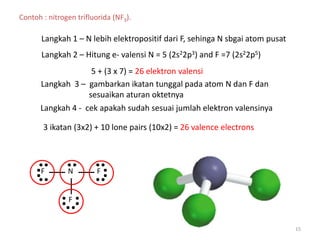
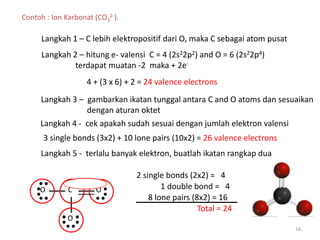
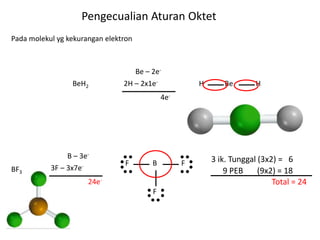
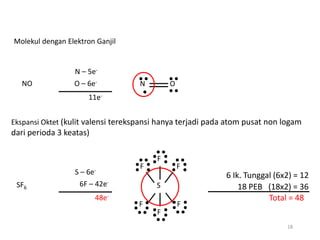
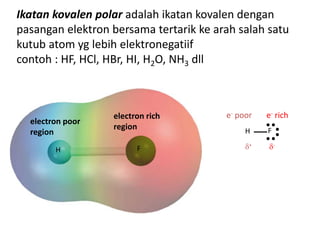
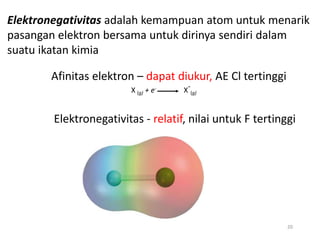
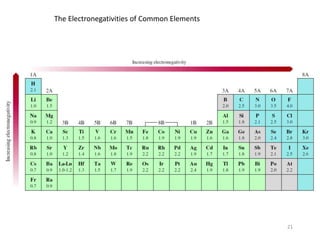
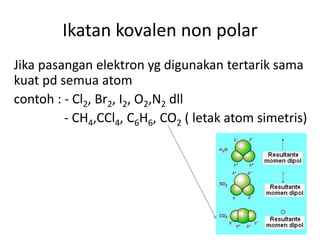
Bab 4 membahas struktur molekul dan ikatan kimia. Ada beberapa jenis ikatan kimia yang dibahas seperti ikatan ion, kovalen, dan logam. Ikatan terbentuk ketika atom-atom berusaha mencapai konfigurasi gas mulia dengan berbagi atau menukar elektron. Unsur-unsur nonlogam cenderung membentuk ikatan kovalen atau ion.




![Li + F Li+
F -
Ikatan Ion
1s22s1
1s22s22p5
[Li]
[F]
Li Li+ + e
-
e
- + F F -
F -
Li+ + Li+
F -
LiF
Terjadi karena adanya gaya elektrostatik yang menahan ion untuk
berikatan antara ion positif dgn negatif
-Terjadi karena perpindahan elektron dari
satu atom ke yg lain
-antara ion positip (+) dan ion negatif (-)
-antara ion logam dan non logam](https://image.slidesharecdn.com/4-221007061311-33bfcdf2/85/4-Ikatan-Kimia-pptx-5-320.jpg)
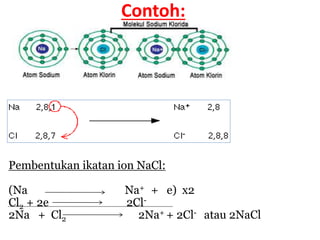

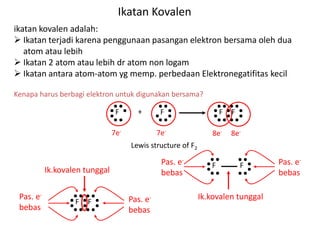
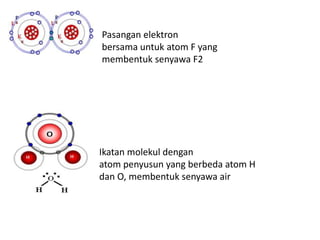


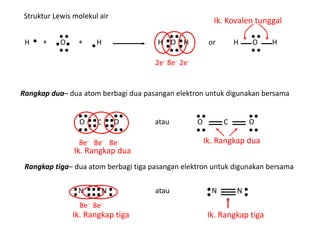
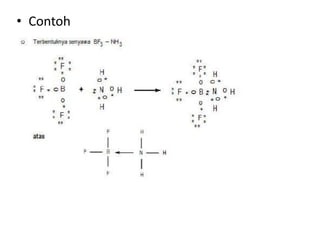

![Ikatan Kovalen Koordinasi /
Koordinat/ Dativ
• Adalah ikatan yang terbentuk dengan cara
penggunaan bersama pasangan elektron yang
berasal dari salah 1 atom yang berikatan
[Pasangan Elektron Bebas (PEB)], sedangkan
atom yang lain hanya menerima pasangan
elektron yang digunakan bersama.
• Pasangan elektron ikatan (PEI) yang menyatakan
ikatan dativ digambarkan dengan tanda anak
panah kecil yang arahnya dari atom donor
menuju akseptor pasangan elektron.](https://image.slidesharecdn.com/4-221007061311-33bfcdf2/85/4-Ikatan-Kimia-pptx-23-320.jpg)