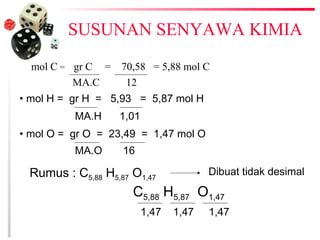
1. Stoikiometri adalah perhitungan zat dan campuran kimia berdasarkan konsep mol dan bilangan Avogadro.
2. 1 mol suatu zat (unsur, senyawa, ion) sama dengan 6,0225 x 1023 partikel zat tersebut.
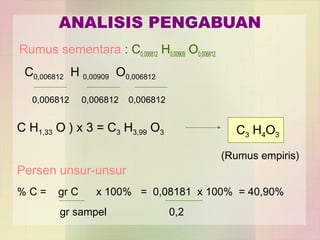
3. Analisis pengabuan digunakan untuk menentukan rumus empiris suatu senyawa organik melalui pembakaran.