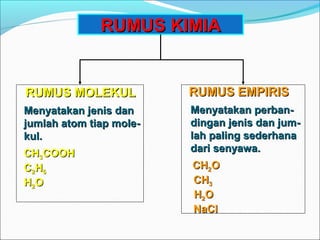
Dokumen tersebut membahas tentang rumus kimia, termasuk rumus empiris dan rumus molekul. Rumus empiris menyatakan perbandingan jenis dan jumlah atom terkecil dalam suatu senyawa kimia, sedangkan rumus molekul menunjukkan jumlah atom sebenarnya dalam molekul senyawa tersebut. Contoh soal dan penyelesaiannya juga diberikan untuk memperjelas konsep rumus empiris dan rumus molekul.