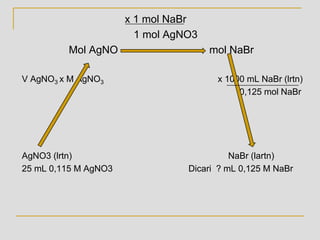
Stoikiometri membahas perbandingan atom dalam reaksi kimia. Satuan dasar jumlah zat kimia adalah mole yang sama dengan 6,022x1023 partikel. Rumus empiris menunjukkan perbandingan terkecil atom dalam senyawa, sedangkan rumus molekul adalah formula sebenarnya. Konsentrasi larutan dinyatakan dalam molaritas yang menunjukkan jumlah mol zat terlarut per liter larutan.