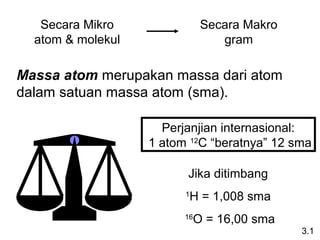
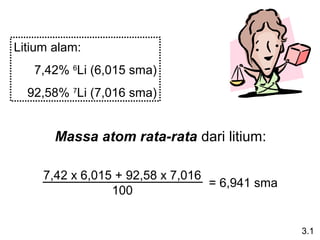
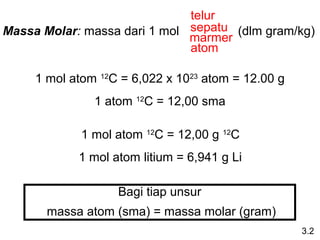
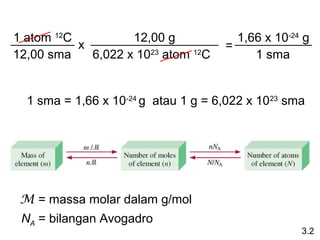
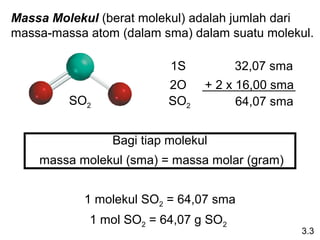
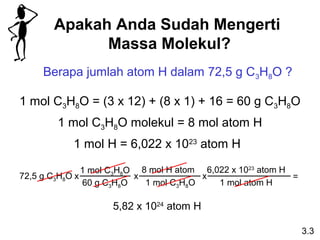
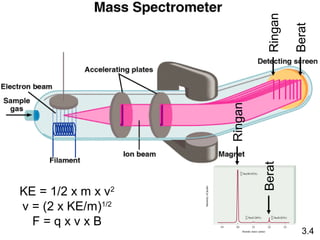
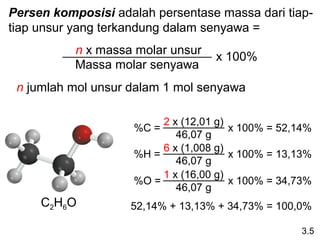
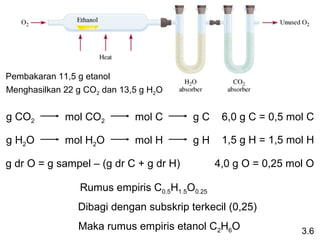
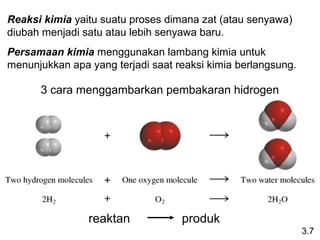
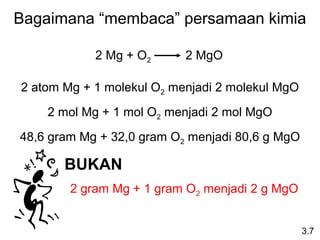
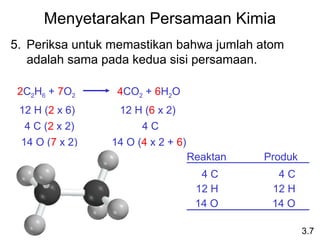
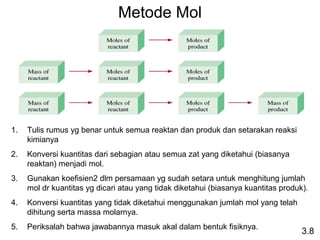
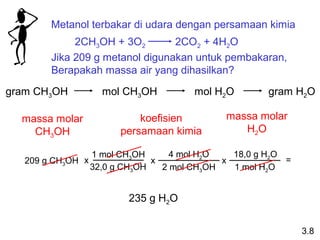
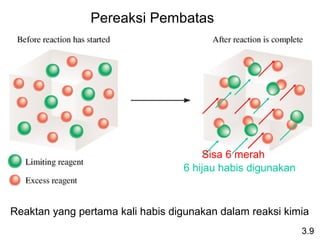
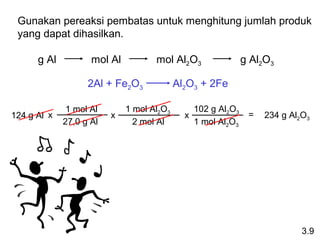
Dokumen ini membahas tentang stoikiometri, termasuk konsep massa atom, massa molar, mol, persen komposisi, dan metode mol dalam menyelesaikan masalah stoikiometri. Juga dibahas tentang reaksi kimia, persamaan kimia, dan pereaksi pembatas. Contoh yang diberikan adalah pembakaran etanol dan produksi pupuk amonium nitrat.