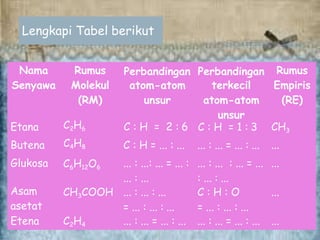
Siswa belajar tentang rumus empiris dan rumus molekul, termasuk cara menentukan kedua rumus tersebut berdasarkan data komposisi unsur dan massa molekul relatif senyawa. Tujuan pembelajaran adalah agar siswa mampu membedakan dan menghitung rumus empiris dan rumus molekul secara tepat.