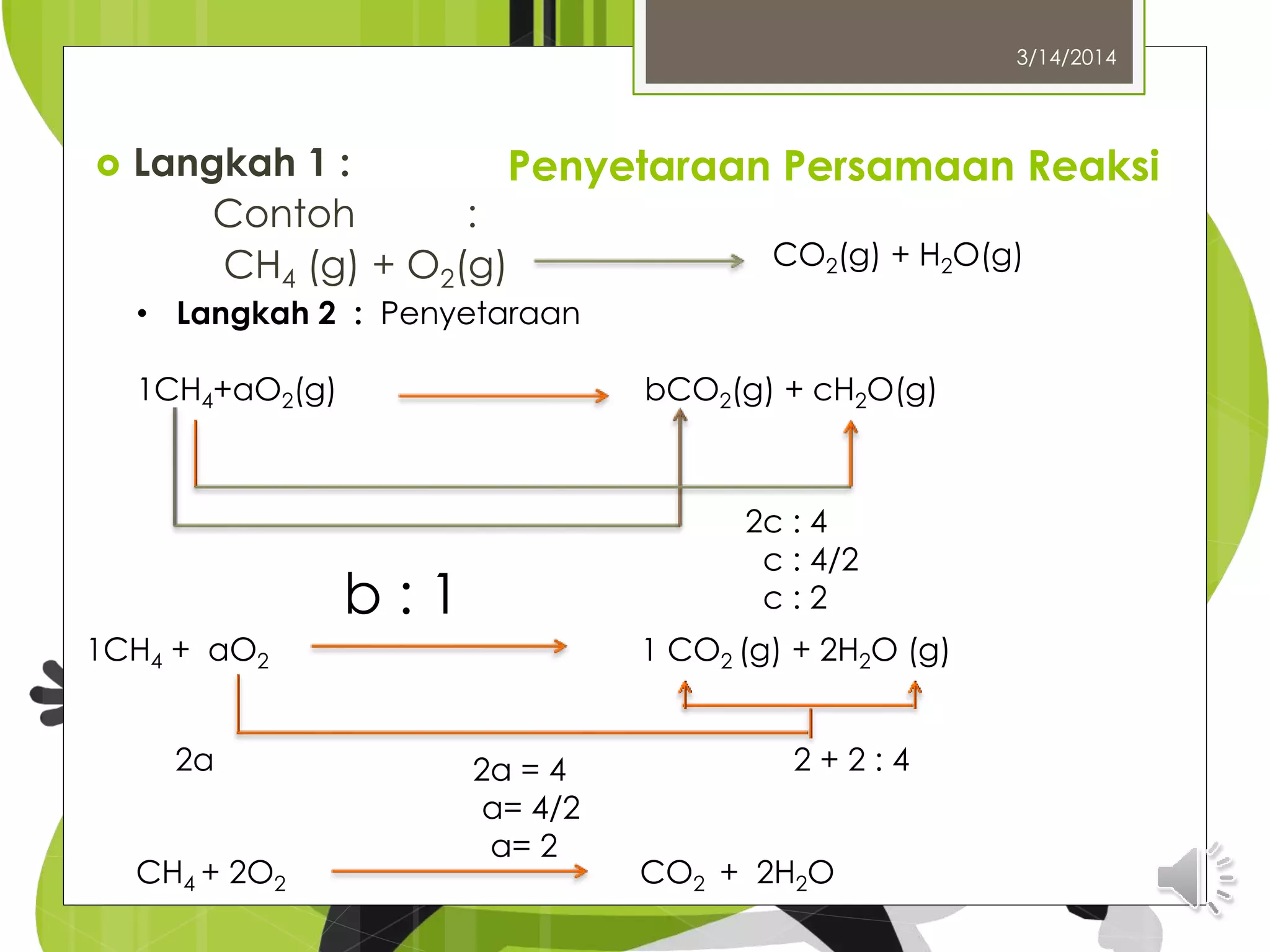
Dokumen ini membahas tata nama senyawa kimia, termasuk senyawa anorganik dan organik, serta hukum dasar kimia seperti hukum kekekalan massa. Dijelaskan pula tentang konsep mol, kemolaran larutan, dan cara menentukan rumus empiris dan molekul suatu senyawa. Penamaan senyawa mengikuti aturan yang ditetapkan oleh IUPAC dan meliputi berbagai jenis senyawa termasuk senyawa ion dan molekul.