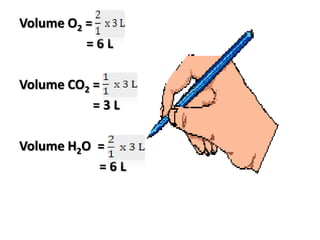
Hukum-hukum dasar kimia meliputi hukum Dalton tentang perbandingan massa unsur dalam senyawa, hukum Gay-Lussac tentang perbandingan volume gas yang bereaksi dan hasilnya, serta hukum Avogadro mengenai hubungan antara volume dan jumlah molekul gas. Ketiga hukum ini memberikan landasan penting dalam memahami reaksi kimia.