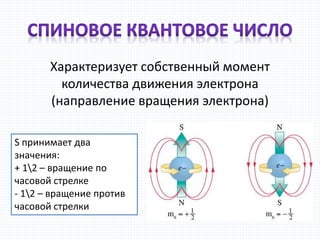
Документ описывает состояние электрона в атоме с точки зрения основных принципов квантовой механики, выделяя его двойственную природу как частицы и волны. Обсуждаются модель электронного облака, вероятностные характеристики нахождения электрона, а также квантовые числа, определяющие энергию и форму орбиталей. Также упоминается образование возбужденных состояний атома при переходе электронов между уровнями энергии.