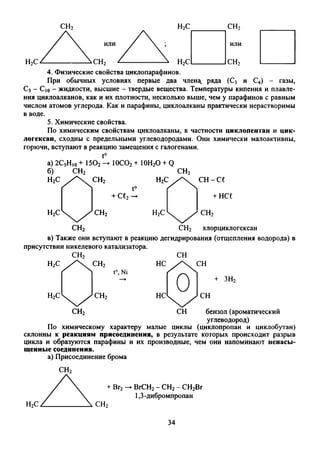
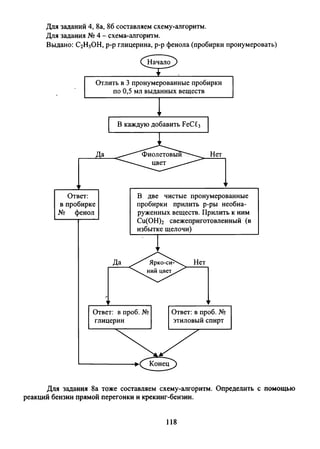
Документ содержит поурочные планы и методические рекомендации для учителей химии 10 класса на основе учебника Г.Е. Рудзитиса и Ф.Г. Фельдмана. Он включает обсуждение периодического закона, строения атома, окислительно-восстановительных свойств и структурных формул органических веществ, а также задания для самостоятельной работы и проверки знаний. Работы защищены авторским правом и направлены на улучшение качества преподавания химии в современных школах.











![Показать правила составления изомеров и дать по ходу урока домашнее
задание: составить возможные изомеры для состава: а) С6Н,4; 6) С7Н)6. При со
ставлении структурных формул изомеров можно записывать только углеродную
цепочку без атомов водорода.
Вывод 1. Наличие изомеров - одна из причин многообразия органических
соединений.
4- е п о л о ж е н и е . По свойствам данного вещества можно определит
строение его молекулы, а по строению - предвидеть свойства.
Доказательство данного положения
Это положение можно доказать на примере неорганической химии.
Пример. Если данное вещество изменяет окраску фиолетового лакмуса на
розовый цвет, взаимодействует с металлами, стоящими до водорода, с основными
оксидами, основаниями, то мы можем предположить, что это вещество относится к
классу кислот, т.е. в своем составе имеет атомы водорода и кислотный остаток. И,
наоборот, если данное вещество относится к классу кислот, то проявляет вышепе
речисленные свойства.
Например: H2S 0 4- серная кислота
а ) H2S 0 4# H + + H S04“
HSP4 ^ H * + SQ42~*5
H2S 0 4 # 2H++ S 0 42'
б) Zn + H2S 0 4 — ZnS04+ H2f ;
в) CuO + H2SO4 —►C11SO4 + H20;
r) 2NaOH + H2S 0 4 -> Na2S 0 4+ 2H20 .
5- е п о л о ж е н и е . Атомы и группы атомов в молекулах веществ вза
имно влияют друг на друга.
Доказательство данного положения
Это положение можно доказать на примере неорганической химии.
Для этого надо сравнить свойства водных растворов NH3, НСС, Н20 (дейст
вие индикатора). Можно демонстрировать.
а) [NH4OH] + лакмус —►синий цвет
rN H ,O H l^ N H / + OH pH > 7
среда щелочная
б) НС£ + лакмус —►розовый цвет
нсг#н++сг рн<7
среда кислая
в) Н20 + лакмус —►остается фиолетовым
НОН # Н++ ОН' pH = 7
среда нейтральная
Во всех трех случаях в состав веществ входят атомы водорода, но они со
единены с разными атомами, которые оказывают различное влияние на атомы во
дорода, поэтому свойства веществ различны. (Или пример из учебника 10 кл. Руд-
зитиса, Фельдмана, стр. 9-10.)
12](https://image.slidesharecdn.com/02-170804112153/85/02-12-320.jpg)











![тана. Но влияние атомов взаимно. Здесь атом хлора не только повлиял на атомы
радикала метила, но и сам испытывает их влияние. Он, например, не отщепляется в
виде иона СV и не образует осадка хлорида серебра при действии на вещество рас
твора нитрата серебра.
10. Получение углеводородов.
а) Получают из газа и нефти.
б) Синтезом из простых веществ (реакция обратима реакции разложения).
С + 2Н2 ^ СИ, + Q J H J1 Cj к M k /t) t
t, к ' 3
в) В лаборатории метан получают
CH3COONa + NaOH -► СН 4 + Na2C 03.
тверд.
г) Другие углеводороды с более длинной углеродной цепью получают из га
логенопроизводных предельных углеводородов с металлическим натрием (реакция
Вюрца)
СН3- [I Na]
+ -> СН3- СН3+ 2Nal
СН3- [I Na]
II. Закрепление знаний, умений, навыков
Задание на дом:
а) глава II, стр. 1 2 -2 2 , записи'в тетради;
б) упр. 7, 8, 9, 16, 18;
в) задачи 1, 2(a), 4;
г) подготовиться к семинарскому занятию.
Тема уроков 3-4 (5). СЕМИНАРЫ ПО ТЕМЕ «ПРЕДЕЛЬНЫЕ УГЛЕ
ВОДОРОДЫ: СТРОЕНИЕ, СВОЙСТВА, ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ»
Цели уроков: 1. Отработать теоретические и практические навыки, закрепить и углу
бить знания, полученные на предыдущих уроках (лекции). 2. Уметь самостоятельно пополнять
и систематизировать свои знания, пользоваться учебником и дополнительной литературой,
соблюдать правила работы в коллективе. Уметь пользоваться приемами сравнения, обобще
ния, делать выводы.
Х о д у р о к а
Учащимся раздаются методички с вопросами и заданиями.
Таблица 4
№
п/п
Вопросы,подле
жащие рассмот
рению
Вопросы и задания Литература
1 2 3 4
1 Строение пре
дельных углево
дородов
1. Запишите молекулярную,
структурную и электронную
формулы метана
2. В чем особенность строения
атома углерода в метане?
3. Какими особенностями
строения молекулы метана
обуславливается его устойчи
вость? Перечислите и поясните
1. Г. Е . Рудзитис,
Ф. Г. Фельдман. Химия. 10.
Органическая химия. М.:
Просвещение, 1991
2. Л. А. Цветков. Органич.
химия (учебн. для 10 кл.). М.:
Просвещение, 1988
3. Э .Е . Нифантьев, Л.А. Цвет
ков. Химия. 10-11. Органиче
ская химия. М.: Просвеще
ние, 1993
4. Лекция
24](https://image.slidesharecdn.com/02-170804112153/85/02-24-320.jpg)












![В а р и а н т 4
1. Закончить уравнения, назвать получившиеся вещества, указать области их
применения:
hv
а) с н 3- с н - с н 3+ се2—
t°
б) циклопентан + Н2—►
(присоедин.)
в) пропан + 0 2—►
t° > 1000°С
г) С7Н16 —
СН3 СН3
2. Дано вещество: СН3- - СН2- i - СН3.
d:H3 <*:н3
Напишите формулы двух его изомеров, назовите их.
3. Задача. Хлоропроизводное предельного углеводорода имеет массу 237.
Состав его следующий: С£ - 89,9%, С - 10,1%. Найдите молекулярную формулу
[Аг(С£) = 35,5].
В а р и а н т 5
1. Закончить уравнения, назвать получившиеся вещества, указать области их
применения.
hv
а) СН3- СН3+ С£2 -►
(2 стадии)
изомеризация
б) бутан —>
t°,K
г) горение гексана
2. Дано вещество:
СН3
I
СН3- СН2- С - СН3
СН3
Напишите формулы двух его гомологов, назовите их.
3. Задача. Вывести молекулярную формулу углеводорода, который со
держит 85,7% углерода и имеет плотность по водороду, равную 21.
Для сильных учащихся - 4 варианта из «Проверочных работ по химии для
9 -1 0 классов» (авторы П. Н. Жуков, Б. Л. Рысе. М: Просвещение, 1985).
Работа № 6 (итоговая), стр. 40-42 - четыре варианта; из них только по
3 вопроса, а вместо четвертого вопроса дать отдельно задачи на карточках:
38](https://image.slidesharecdn.com/02-170804112153/85/02-38-320.jpg)



![t°
C2H4+ 302-> 2C02+ 2H20 + Q.
Это свойство не используют, т. к. алкены являются ценным химическим
сырьем.
б) Частичное окисление этилена кислородом воздуха (под действием катали
затора)
A g , t°
2СН2= СН2+ 0 2 -> 2Н2С - СН2
оксид этилена
Эта реакция имеет большое значение в органическом синтезе. Его (оксид
этилена) используют для производства уксусного альдегида, синтетических мою
щих средств, лаков, пластмасс, синтетических каучуков и волокон, косметических
препаратов и других веществ.
в) Неполное окисление (окислитель - раствор КМп04) - первая качествен
ная реакция на алкены.
Н2С = СН2+ [О] + н2о — Н2С - сн2
окислитель | |
ОН ОН
этиленгликоль
В результате реакции происходит обесцвечивание раствора (перманганата
калия), что указывает на непредельный характер вещества.
Полученное вещество (этиленгликоль) используют для получения антифри
зов (незамерзающих жидкостей), растворителей.
Это свойство и все последующие свойства доказывают строение алкенов.
Реакции присоединения
Так как алкены являются ненасыщенными соединениями (в молекуле есть
двойная связь), они могут вступать в реакции присоединения.
а) Взаимодействие с галогенами:
с бромной водой
СН2= СН - СН3+ Вг2 — СН2- СН - СН3 1,2 дибромпропан
i ! L i
В результате реакции происходит обесцвечивание бромной воды - это вто
рая качественная реакция на алкены.
с хлором (С(2)
Н2С = СН2-I- С12—>Н2С - СН2 1,2-дихлорэта - это вещество является
и и ,
хорошим растворителем (смол), используется для очистки текстильных материалов.
Также 1,2-дихлорэтан применяют для получения синтетических каучуков, в сель
ском хозяйстве для обеззараживания зернохранилищ в борьбе с болезнями
растений.
б) Присоединение водорода (реакция гидрирования):
t°
Н2С = СН2+ Н2—►Н3С - СН3этан
этилен К
42](https://image.slidesharecdn.com/02-170804112153/85/02-42-320.jpg)












![Взаимодействие с бромной водой (качественная реакция)
I стадия НС = СН + Вг2—►СН = СН 1,2-дибромэтен
Аг ir
II стадия НС = СН + Вг2— СНВг2- СНВг2
J r 1,1,2,2-тетрабромэтан
В результате реакции происходит обесцвечивание бромной воды.
Взаимодействие с хлором.
Может сразу присоединиться 2 молекулы хлора.
н с = с н + 2се2— с н с е 2- с н с е 2
1,1,2,2-тетрахлорэтан (это хороший растворитель)
Путем дальнейшей переработки этого вещества получают хлоро
производные, например трихлорэтен - растворитель высокого качества - для
чистки одежды (получают его при отщеплении от последней молекулы НС€);
[С£ Н]
н - с - с - с е — с н = с с е 2+ нсе
се се te
1,1,2,2-тетрахлорэтан 1,1,2-трихлорэтен
б) Присоединение водорода (гидрирование)
+Н2 +Н2
С2Н2 -> С2Н4 - С2Н*
t°, К t°, К
ацетилен этилен этан
Здесь прослеживается связь между ацетиленовыми, этиленовыми, предель
ными.
в) Гидрогалогенирование (присоединение галогеноводородов)
t°
НС = СН + НСе —► Н2С = СНСе хлорэтен (винилхлорид)
Hgce2
Полимеризацией продукта реакции получают полимер - поливинил-хло
рид - пластмассу, идущую на изготовление плащей, проводов, клеенки, искусст
венной кожи, труб и т. д.
п СН2= £ н — ( - СН2-С Н ^ ( - С Н 2- С Н - ) П
се се
винилхлорид поливинилхлорид
г) Присоединение воды (гидратация)
1°
НС=СН+Н20 — СНз-C f
HgS04 н
(это реакция Кучерова) уксусный альдегид
Продукт реакции используют для получения уксусной кислоты, которая ис
пользуется в производстве парфюмерных изделий (духов, одеколонов), в пищевой
промышленности (фруктовые эссенции), в производстве искусственных волокон,
красителей, лаков, синтетических каучуков.
55](https://image.slidesharecdn.com/02-170804112153/85/02-55-320.jpg)
![д) Реакции полимеризации
Тримеризация ацетилена (реакция Зелинского)
СН
ЗНС = СН
t° = 400-500°C
---------------- ►НС
активир. уголь
НС
СН
СН
бензол
СН
Бензол используют для получения растворителей, красителей, каучуков,
пластмасс.
Димеризация ацетилена
Сисг2
НС=СН+НС=СН — НС=С- СН=сн2
NH3, Н20
винилацетилен
Из винилацетилена получают хлоропрен.
НС = С - СН = СН2+ нее — СН2= С - СН = СН2 хлоропрен -
се
используют для получения каучука, из которого изготавливают шланги для пере
качки масла и растворителей.
е) Особое свойство ацетилена - реакция замещения.
Под действием тройной связи ослабевает связь в молекуле ацетилена между
атомами углерода и водорода (С - Н) и водород становится подвижным, может за
мещаться.
НС CAg
[И+ AgzO -> ||| +Н20
НС аммиачный CAg ацетиленид серебра
раствор (осадок)
Более точно уравнение реакции с ацетиленом записывают так:
НС - СН + 2[Ag(NH3)2] ОН -►AgC = CAg + 2Н20 + 4NH3
комплексное
соединение -
аммиакат
серебра
ж) Реакции окисления
Неполное окисление: окислитель - раствор КМп04- качественная реакция.
НС = СН + [0] — с = о
| ОН щавелевая
С<^О кислота
ОН
В результате реакции розовая окраска раствора КМп04 исчезает, раствор
обесцвечивается.
56](https://image.slidesharecdn.com/02-170804112153/85/02-56-320.jpg)








![молекулы бензола, способы его получения и применения. 2. Уметь объяснять свойства бензо
ла на основе его строения, записывать уравнения реакций, доказывающие химические свойст
ва бензола. Уметь сравнивать химические свойства бензола со свойствами предельных и не
предельных углеводородов. Иметь представление о ядохимикатах, условиях их использования
в сельском хозяйстве на основе требований охраны природы. 3. Продолжить формирование
мировоззренческих понятий: о причинно-следственной связи между составом, строением,
свойствами и применением бензола; выявить общее и особенное на примере химических
свойств бензола, раскрыть многообразие генетических связей между углеводородами.
По ходу урока демонстрация тех опытов, которые требуются по программе.
I. Изучение нового материала
1. Понятие об ароматических углеводородах (см. учебник, стр. 51).
2. Вывод молекулярной формулы бензола. Решение задачи.
В 1825 году Майкл Фарадей открыл в светильном газе углеводород состава:
С - 92,3%, а Н - 7,7%. Плотность его паров по воздуху составляет 2^69. Найти мо
лекулярную формулу вещества. Что можно сказать о его строении?
Учащиеся решают задачу и приходят к выводу, что формула вещества
СбН6- это бензол. Также они предполагают, что это вещество должно иметь непре
дельный характер.
3. Выяснение строения бензола:
а) Доказательством непредельности вещества может служить качественная
реакция с бромной водой. (Демонстрация опыта взаимодействия бензола с бромной
водой.)
С6Н6+ Вг2—►(бромная вода не обесцвечивается, реакция не идет).
(Демонстрация опыта взаимодействия бензола с раствором КМп04.)
С6Н6+ [О] —►(реакция не идет, раствор КМп04не обесцвечивается)
р-р КМп04
Тогда возникает противоречие: по составу - непредельный углеводород, а
по свойствам - предельный?
4. Вывод формулы бензола. Первую структурную формулу бензола предло
жил в 1865 г. немецкий химик А. Кекуле. Он представил формулу бензола в виде
правильного шестиугольника с чередующимися простыми и двойными связями, в
котором каждый атом углерода связан с водородным атомом.
Х од 1-го у р о к а
Н
, или условно
Н -С С -Н
С
Н
65](https://image.slidesharecdn.com/02-170804112153/85/02-65-320.jpg)



![Эта реакция может идти дальше:
no2+ н2о
1,3-динитробензол, или мета
динитробензол
В реакциях замещения при вступлении в молекулу второго заместителя мо
гут образовываться три изомера, отличающиеся взаимным положением заместите
лей: орто-, мета- или параизомеры.
Это зависит от уже имеющегося в бензольном ядре заместителя. Все замес
тители (по ориентирующему действию) в реакциях замещения в бензольном ядре
можно разделить на две группы.
Заместители 1-й группы (первого рода): углеводородные радикалы, груп
пы - ОН, - NH2, галогены и др. Они направляют последующие заместители в орто-
и параположение.
Заместители 2-й группы (второго рода). Это группы - N02,
S02, - ОН, - СООН, - CN и др. Они направляют последующие заместители в мета
положение.
в) Взаимодействие бензола с серной кислотой (сульфирование)
t° .
>/ Nv . [ H + H 0 ]-S 0 2-0 H ----------►(/ _ v^ s° 2 -O H
о конц. серная
кислота
X X
О
чх
+н2о
бензолсульфокислота
Реакции присоединения
а) Присоединение галогенов (в отсутствии кислорода)
СН
о СН
НС
н .
СН освещение
+зсе2 -------- ►cv
н
сг-с-н
.н
"С£
Н
СН
V Va j . С£
н се
гексахлорциклогексан
(гексахлоран)
69](https://image.slidesharecdn.com/02-170804112153/85/02-69-320.jpg)


![Ближайшие гомологи бензола - бесцветные жидкости с характерным
запахом, высшие гомологи - твердые вещества. Температуры кипения и плавления
зависят от состава и изомерии боковых цепей. Изомеры с разветвленными
боковыми цепями обычно кипят при более низких температурах, чем с
нормальными. Плотность аренов всегда меньше единицы. Они малорастворимы в
воде, но во всех соотношениях смешиваются с органическими растворителями -
спиртом, эфиром, ацетоном. Жидкие арены сами являются хорошими
растворителями органических веществ.
I 4. Химические свойства (на примере толуола).
Гомологи бензола сходны по строению с бензолом, следовательно, прояв
ляют сходные химические свойства, но имеют и свои особенности. Рассмотрим на
примере толуола. В молекуле последнего происходит взаимное влияние атомов.
а) Влияние радикала (-СН3) на бензольное кольцо. Для этого мы сравним
взаимодействие с азотной кислотой (нитрование) у бензола и толуола.
n o 2
+ ЗН20
2,4,6-тринитротолуол, или тол, или
тротил - взрывчатое вещество
[H + H 0 ]-N 0 2-
к. H2S04
+н2о
бензол нитробензол
Из приведенных примеров видно, что толуол гораздо легче вступает в реак
цию замещения (нитрования), чем бензол. К тому же замещению подвергаются не
один, а три атома водорода в положении 2,4, 6. Следовательно, радикал - СН3(ме-
тильная группа) влияет на бензольное кольцо. Под действием этого радикала
(- СН3), который смещает электронную плотность в сторону бензольного ядра, на
рушается равномерное расположение электронных облаков в последнем (бензоль
ном ядре). При этом происходит смещение электронной плотности в ядре в поло
жениях 2,4,6 (она увеличивается) и атомы водорода здесь легче подвергаются за
мещению. СН3
Но влияние атомов взаимно.
72](https://image.slidesharecdn.com/02-170804112153/85/02-72-320.jpg)
![б) Влияние бензольного кольца на радикал. Для этого сравним взаимодейст
вие с раствором КМп04у толуола и метана.
Метан устойчив к действию окислителей.
СН4+ [О] 7^ реакция не идет
р-р КМп04
Если же раствор перманганата калия (КМп04) мы прильем к толуолу и смесь
нагреем, то заметим, что фиолетовый раствор КМп04 постепенно обесцвечивается.
Это происходит потому, что под влиянием бензольного кольца метальная группа
становится активной и легко окисляется, превращаясь в карбоксильную группу:
Вообще толуол можно рассматривать не только как бензол, в молекуле ко
торого атом водорода замещен на метальную группу, но и как метан, в молекуле
которого атом водорода заменен ароматическим радикалом фенилом - С(>Н5.
в) Кроме нитрования ароматические углеводороды вступают и в другие ре
акции, свойственные бензолу. Они могут реагировать, например:
с галогенами (по месту атомов водорода в бензольном кольце);
с галогенами (в боковой цепи);
присоединение водорода;
полное окисление.
Составьте самостоятельно дома уравнения этих реакций на примере
толуола.
5. Применение и получение.
а) Гомологи бензола используются в качестве растворителей, а также для
производства красителей, лекарств, взрывчатых веществ, душистых веществ и т.д.
Толуол в большом количестве используется в качестве топлива, как раство
ритель и для синтеза взрывчатых веществ, полупродуктов анилинокрасочной и
фармацевтической промышленности. Больше половины производимого толуола
переводится в бензол:
толуол бензойная кислота
толуол
73](https://image.slidesharecdn.com/02-170804112153/85/02-73-320.jpg)





















![II. Изучение нового материала
1. Понятие о многоатомных спиртах, их состав, строение (см. учебник, гл. 7,
| 2, сгр. 85-86).
2. Физические свойства многоатомных спиртов. (См. учебник, гл. 7, § 2,
стр. 86.)
Дополнение. Физические свойства многоатомных спиртов отличаются от
одноатомных, т.к. влияет строение. С увеличением групп -ОН увеличивается тем
пература кипения и растворимость в воде. Это объясняется установлением водо
родных связей между молекулами спиртов в первом случае и установлением водо
родных связей между молекулами спирта и воды во втором случае.
3. Химические свойства.
Вспомните, какие типы реакций характерны для одноатомных спиртов?
Химические свойства глицерина и этиленгликоля сходны с химическими
свойствами одноатомных спиртов.
а) 1-й тип. Реакция полного окисления.
р н 2
t°
2С2Н4(ОН)2+ 502— 4С02+ 6Н20;
б) 2-й тип - реакции замещения.
Взаимодействие с металлическим натрием.
i2- ОН СН2- ONa
+ 2Na -►| + Н2
СН2- ОН СН2- ONa
Взаимодействие с азотной кислотой.
р н 2- 0[Н t° |ГН2- О - N02
<рн - о[н + зно] - n o 2 — рн - О - N02 + ЗН20
СН2-0 [Н к. H2S04 c h 2- o - n o 2
тринитрат глицерина, или нитро
глицерин (сложный эфир)
Взаимодействие с хлороводородом.
СН2- [ОН СН2- а
| + Н]С£ — | + Н20
с н 2- о н СН2ОН
2-хлорэтанол
в) 3-й тип - реакции дегидратации
i2-0 [H НО]-СН2 t° СН2- 0 - С Н 2
+ — I [ + 2Н20
СН2-0 [Н НО]-СН2 к h2so4 с н 2- о - с н 2
диоксан (хороший растворитель)
2. Качественной реакцией на многоатомные спирты является взаимодейст
вие их со свежеосажденным гидроксидом меди (И).
Например:
£Н2- 0[Н НОК СН2- O v
фн-0[н + )Cu—£н-0 — Cu+2H20
сн2- он но]/ дн2- он
образуется раствор ярко-синего цвета -
глицерат меди (II)
<^Н2
95](https://image.slidesharecdn.com/02-170804112153/85/02-95-320.jpg)









![Вследствие этого температуры кипения альдегидов ниже, чем у спиртов с
ЮМже числом углеродных атомов. Растворимость в воде первых членов гомологи
ческого ряда альдегидов можно объяснить установлением водородных связей с
Молекулами воды.
R - C
0 “--------+Н - 0
I
н н
6. Химические свойства альдегидов. Химические свойства альдегидов обу
словлены составом и строением данных веществ и прежде всего наличием в их мо
лекуле карбонильной группы.
Дальше см. учебник, гл. 8, § 1, стр. 100.
Дополнение
а) Для альдегидов характерна также реакция полного окисления:
О Г
Н - + 0 2— С02+ Н20 + Q.
ЧН
б) Реакция присоединения с водой (реакция гидратации).
Н - ® + Н :О Н Н — С - ОН гидратная форма - в таком виде фор-
н н
мильдегид существует в растворе (но равновесие сильно сдвинуто вправо —►).
в) Реакция поликонденсации (взаимодействие формальдегида с фенолом):
•?н
ОН
о
фенол
»Н
О
у [Н + + Н]
СН2
формаль
дегид
ОН
о
О
[Н + + Н]
сн2
[н +...
ч /
сн2 Н2
о
ЧУ
о
ЧУ
о
Ч У
... + пН20
ч Полимер (фенолформальдегидная смола - пластмасса).
Реакция поликонденсации - это реакция образования высокомолекулярно
го вещества и побочного низкомолекулярного продукта (например вода).
7. Получение альдегидов.
См. учебник, гл. 8, § 1, стр. 98 - 99.
8. Применение альдегидов. См. учебник, гл. 8, § 1, стр. 101 (можно дать на
дом самостоятельно).
105](https://image.slidesharecdn.com/02-170804112153/85/02-105-320.jpg)






















![Тема 9. УГЛЕВОДЫ
Тема уроков 1-2. ГЛЮКОЗА: СОСТАВ, СТРОЕНИЕ, СВОЙСТВА,
ПРИМЕНЕНИЕ
Цели уроков: 1. Познакомить учащихся с важнейшими представителями углеводов.
2. Знать классификацию углеводов, состав и строение глюкозы, области ее применения.
3. Уметь на основании строения предсказывать свойства глюкозы, составлять уравнения реак
ций окисления, восстановления, брожения. Иметь представление об изомере глюкозы - фрук
тозе.
Х о д у р о к о в
По ходу уроков проводят те демонстрации и лабораторные опыты, что тре
буются по программе.
I. Изучение нового материала
1. Понятие об углеводах. Классификация (см. учебник, гл. 10, стр. 125).
2. Состав и строение молекул глюкозы. Изомерия. (См. учебник, гл. 10,
§ 1, стр. 126-127.)
3. Нахождение в природе, физические свойства (см. учебник, гл. 10, § 1,
стр. 127-128).
4. Химические свойства глюкозы (см. учебник, гл. 10, § 1, стр. 128-129, таб
лица 16).
Дополнение. Те реакции, которых нет в таблице, можно дать учащимся до
писать дома самостоятельно или самому учителю написать в классе.
Например, свойства глюкозы как многоатомного спирта.
а) Взаимодействие с карбоновыми кислотами с образованием сложных эфи
ров:
Н О у />
Н -С ^-0[Н
Н. .0
Y
н- С- О- С,
о
HJO-C-H + 5 /С-СНз —►
Н- 9 - 0[Н НО] к. H2S04
Н - 9 - 0[Н
Н - С - 0 [ Н
h
ft I
9 - о-с-н
сн , I
Н - С- О- Сч
СН3 + 5Н20
.0
Н - С- О - Q
СН3
'сн3
»о
н - ^ - о - с
Н СН3
пентаацетил глюкозы
б) Взаимодействие с гидроксидом меди (II) (качественная реакция на много
атомные спирты):
131](https://image.slidesharecdn.com/02-170804112153/85/02-131-320.jpg)
![н//° V 0
Н- £- ОН НО] н- р- он
но - р- н + 'си — но-р-н
Н-£-0[Н НО] н -р -ох
Н-С-0[Н н-р-о^-
н- р- он н-р-он
н н
глицерат меди (ярко-синего цвета)
Свойства глюкозы как альдегида.
а) Взаимодействие с гидроксидом меди (II) при нагревании (качественна
реакция «медного зеркала» - неполное окисление).
/О t°
1ст. СН2ОН-(СНОН)4-С + 2 Cu(OH)2 —
— СН2ОН - (СНОН)4- + 2 СиОН + Н20
*ОН
t°
II ст. 2 СиОН -► Си20 + Н20
красно-коричневого цвета
б) Взаимодействие с водородом (восстановление)
СН2ОН - (СНОН)4- + Н2 —* СН2ОН-(СНОН)4-С Н 2ОН
Н К шестиатомный спирт-сорбит
Как органическое вещество глюкоза подвергается полному окислению (это
происходит в клетках живого организма).
СбН120 6+ 6 0 2 -► 6С 02+ 6Н20 + Q.
Чаще этот процесс идет последовательно через целый ряд стадий и сопро
вождается выделением энергии.
5. Применение глюкозы (см. учебник, гл. 10, § 1, стр. 128).
6. Получение (см. учебник, гл. 10, § 1, стр. 128).
Дополнение
В природе глюкоза наряду с другими углеводами образуется в результате
процесса фотосинтеза.
хлорофилл
6С 02 + 6Н20 — СбН120 6- Q.
свет
В процессе этой реакции аккумулируется энергия Солнца.
П. Закрепление знаний, умений, навыков
1. Задание на дом. Гл. 10, § 1, стр. 125-129. Записи в тетради Упр. 5, 6, 7,
8(a).
2. Закрепление знаний (если останется время в конце второго урока, то мож
но выполнять упражнения из учебника Л. А. Цветкова «Органическая химия».
М.: Просвещение, 1988):
а) Упр. 1, 2 к § 35, стр. 151.
132](https://image.slidesharecdn.com/02-170804112153/85/02-132-320.jpg)







![этерификации вступают одна, две или три гидроксильные группы каждого звена
молекулы целлюлозы, например:
/ ОН H2S04 / О - N02
[С6Н70 2- OH]n+ 2nHO - N02 -► [С6Н70 2- О - N02]n+ 2пН20
^ О Н О Н
динитроцеллюлоза, или динитрат
целлюлозы
или
/ ОН H2S04 / о - n o 2
[С6Н70 2- ОН]п+ ЗпНО - N02 -► [С6Н70 2- О - N02]n+ ЗпН20
о н ^ о - ы о 2
тринитроцеллюлоза, или тринитрат
целлюлозы
б) При взаимодействии целлюлозы с уксусным ангидридом (в присутствии
уксусной и серной кислот) получается триацетилцеллюлоза, или диацетилцеллюло-
0 - С
*0
'ч'СН3
[С6Н70 2- о - .
ХСНз
он
диацетилцеллюлоза, или диацетат целлюлозы
0 - С 1
[С6Н70 2- 0 - С
О - С
Р
чсн3
>0 ]
ЧСН3
# о
ЧСН3
триацетилцеллюлоза, или триацетат целлю-
зы
Запишите дома уравнения данных реакций получения этих веществ.
Отличные свойства
1. При нагревании древесины (целлюлозы) без доступа воздуха происходи
термическое разложение целлюлозы. При этом образуются летучие органические
вещества, вода, древесный уголь. В числе органических продуктов разложения дре
весины - метиловый спирт, уксусная кислота, ацетон.
(С6Н10О5)п
t°
без доступа
воздуха
.0
СН4;
метан
СН3 - С '
Х 0Н
уксусная кислота
СН3ОН;
метанол
СН3- С - СН3; Н20;
6ацетон
уголь и другие продукты
140](https://image.slidesharecdn.com/02-170804112153/85/02-140-320.jpg)







