Dokumen ini membahas metode sol-gel dalam sintesis nanopartikel, menjelaskan proses hidrolisis dan kondensasi untuk menghasilkan senyawa anorganik dan keuntungan dari metode tersebut, seperti kemurnian tinggi dan biaya yang relatif rendah. Rute logam organik dan anorganik serta pengaruh pH terhadap ukuran partikel juga diuraikan, bersama dengan hasil karakterisasi titanium dioksida (TiO2) setelah sintesis. Kesimpulan menunjukkan bahwa meningkatnya suhu kalsinasi memperbesar ukuran partikel TiO2 dan memberikan kemurnian tinggi pada produk.

![Proses Sol-Gel
A. Pendahuluan
Nanopartikel menjadi kajian menarik dalam bidang material. Ukuran nanometer
meberikan banyak keuntungan diantaranya memberikan nilai tambah suatu bahan
material, untuk mencapai bahan material yang efisien, hemat dan ramah lingkungan.
Terdapat dua metoda yang dilakukan untuk mencapai tujuan tersebut. Metoda sintesis
nanopartikel itu adalah top down dan bottom up. Proses top down tidak melibatkan
reaksi kimia, terjadinya pemecahan material dari ukuran besar ke ukuran kecil.
Sedangkan proses bottom up terjadi reaksi kimia dari material awal sehingga
dihasilkan material lain berukuran nanometer. Dalam proses bottom up dikenal
dengan metoda sol-gel. Proses sol gel dapat didefinisikan sebagai proses
pembentukan senyawa anorganik melalui reaksi kimia dalam larutan pada suhu
rendah, dimana dalam Proses tersebut terjadi perubahan fasa dari suspensi koloid (sol)
membentuk fasa cair kontinyu (gel) [1].
Gambar 1. Proses fisika dan kimia dalam sintesi nanomaterial
Sol-gel merupakan bagian dari koloid. Koloid adalah suspensi dengan fasa
terdispersi yang sangat kecil yaitu sekitar 1-1000 nm. Sol merupakan suspensi partikel
padat yang terdispersi dalam cair. Sedangkan gel merupakan suspensi koloid cair yang
terdispersi dalam padat. Aerosol merupakan suspensi koloid partikel dalam gas atau yang
sering dikenal dengan embun. Untuk hasil akhir dari proses sol-gel sering dikenal dengan
keramik [2].](https://image.slidesharecdn.com/tugassolgel-141229083613-conversion-gate01/85/Sol-gel-2-320.jpg)
![Gambar 2. Alur Proses sol gel
Proses sol gel bisa didefinisikan sebagai proses pembentukan senyawa anorganik
melalui reaksi kimia dalam larutan pada suhu rendah, dalam proses tersebut terjadi
perubahan fasa dari suspensi koloid (sol) membentuk fasa cair kontinyu (gel). Metoda
sol-gel merupakan metoda yang paling banyak dilakukan. Hal ini disebabkan karena
beberapa keunggulannya, antara lain: proses berlangsung pada temperatur rendah,
prosesnya relatif lebih mudah, bisa diaplikasikan dalam segala kondisi (versatile),
menghasilkan produk dengan kemurnian dan kehomogenan yang tinggi jika parameternya
divariasikan. Dimana bisa dilakukan kontrol terhadap ukuran dan distribusi pori dengan
mengubah rasio molar air/prekursor, tipe katalis atau prekursor, suhu gelasi, pengeringan,
dan proses stabilisasi [3]. Selain itu, yang paling mengesankan dari proses sol-gel adalah
biayanya relatif murah dan produk berupa xerogel silika yang dihasilkan tidak beracun
[2].
B. Tahapan Hidrolisis dan Kondensasi
Dari beberapa tahapan proses sol-gel, terdapat dua tahapan umum dalam pembuatan
oksida logam melalui proses sol-gel, yaitu hidrolisis dan kondensasi yang terjadi pada no.
2 pada gambar 2.](https://image.slidesharecdn.com/tugassolgel-141229083613-conversion-gate01/85/Sol-gel-3-320.jpg)
![Pada tahap hidrolisis terjadi penyerangan molekul air. Logam prekursor (alkoksida)
dilarutkan dalam alkohol dan terhidrolisis dengan penambahan air pada kondisi asam atau
basa [4] atau netral menghasilkan koloid. Hidrolisis terjadi penggantian ligan alkoksi (-
OR) dengan gugus hidroksil (OH) [2].
Reaksi kondensasi akan terjadi setelah terjadinya reaksi hidrolisis. Produk dari
reaksi intermediet hasil reaksi hidrolisis sangat berperan dalam proses reaksi kondensasi,
sehingga didapatkan nanopartikel kondensasi juga ada dikenal dengan kondensasi alkohol
dan kondensasi air.
Reaksi Sol Gel
(1) Hidrolisis metal alkoksida
(2) Kondensasi
Ada dua pendekatan yang saat ini dikenal yaitu pendekatan dengan rute logam organik dan
anorganik.
1. Metal Organic Route
Rute logam organik lebih sering dikenal dengan alkoksida logam yang dilarutkan
dalam larutan organik yang terjadi reaksi oxolation atau olation pada jembatan hidrogen.
2. The Inorganic Route
Rute ini menggunakan garam logam yang dilarutkan dalam larutan air (klorida,
oksiklorida, dan nitrat). Rute ini lebih murah dan lebih mudah untuk dikerjakan daripada
alkosida (rute organik), tetapi reaksinya lebih sulit untuk dikontrol [5].](https://image.slidesharecdn.com/tugassolgel-141229083613-conversion-gate01/85/Sol-gel-4-320.jpg)
![C. Penggunaan Katalis dalam Metoda Sol Gel
Katalis pada proses sol-gel sangat berpengaruh pada ukuran kristal dari produk.
Katalis yang digunakan harus dapat lepas pada proses kalsinasi. Katalis yang biasa
digunakan dalam rute organik yaitu amonia (kondisi basa) pada sintesis silika.
Pertambahan konsentrasi amonia mempengaruhi ukuran dari silika yang terbentuk.
Dengan meningkatnya konsentrasi dari amonia, maka ukuran partikel dari silika akan
semakin besar. Reaksi hidrolisis dan kondensasi terjadi dengan cepat seiring
meningkatnya konsentrasi dari amonia, sehingga nukleasi berlangsung dengan singkat
yang berakibatkan ukuran partikel silika relatif lebih besar [6].
Gambar 3. Mekanisme raksi menggunakan katalis asam dan basa pada hidrolisis
Dari gambar diatas dapat dilihat katalis asam dan basa memiliki mekanisme yang
berbeda dalam proses hidrolisis dan kondensasi. Pada reaksi dengan menggunakan katalis
asam, yang pertama terjadi adalah protonasi pada grup alkoksil. Si memberikan
elektronnya kepada grup alkoxyl yang terprotonasi sehingga Si bersifat elektrofilik
sehingga memudahkan molekul H2O masuk. Molekul air akan menyerang Si dari arah
yang berlainan dari gugus hidroksil yang terprotonasi. Setelah gugus air masuk, gugus
alkohol akan lepas dan gugus air akan melepaskan protonnya. Sedangkan katalis basa,
tahap awal reaksi adalah silikon akan diserang oleh gugus hidroksil. Dengan masuknya
gugus hidroksil akan membuat bentuk intermediet berupa Si dengan betuk pentakordinat.](https://image.slidesharecdn.com/tugassolgel-141229083613-conversion-gate01/85/Sol-gel-5-320.jpg)
![Bentuk pentakoordinat dari Si tidak stabil sehingga gugur OR dengan ukuran yang lebih
besar akan lebim mudah lepas.
D. Pengaruh pH (water glass sytem)
Dalam metoda sol-gel sangat dipengaruhi dengan pH sebagai kondisi terjadi reaksi.
pH berkontribusi atas efek hidrolisis dan kondensasi selama proses pembentukan gel serta
terhadap bentuk morforlogi dari produk yang disintesis. Pengaruh variasi pH yang
dilakukan terhadap sintesis nanopartikel ZnO dengan metoda sol-gel, dilakukan titrasi
NaOH untuk pengatur pH 7-12. Pada pH yang lebih rendah (pH=7) meenunjukkan
distribusi partikel yang lebih kecil (1,3 nm+0,3nm), sedangkan pada pH yang tinggi (pH -
12) memberikan kemurnian terhadap hasil ZnO yang terbentuk dengan ukuran partikel
yang lebih besar (73,8 nm + 149,3 nm) [7].
Gambar 4. Data karakterisasi XRD Variasi pH Sintesis ZnO
Penurunan pH dilakukan dengan penambahan HCl pada Natrium silikat sehingga
pembentukan gel menjadi lebih lambat. Maka, pH dinaikkan dengan penambahan larutan
NaOH 1M sehingga pH menjadi 7 dan proses pembentukan polimerasi menjadi lebih
cepat[8]. Peningkatan pH maka ukuran partikel akan bertambah hal ini dapat dilihat dari
morfologi partikel [1].](https://image.slidesharecdn.com/tugassolgel-141229083613-conversion-gate01/85/Sol-gel-6-320.jpg)





![IV. Kesimpulan
Dari hasil dan pembahasan dari karakterisasi yan dilakukan terhadap TiO2 dapat disimpulkan,
sebagai berikut:
1. TiO2 nanomaterial telah disintesis dengan menggunakan metoda sol-gel yang bekerja
pada suhu rendah. Metoda ini memiliki banyak keuntungan salah satunya
memberikan kemurnian yang tinggi.
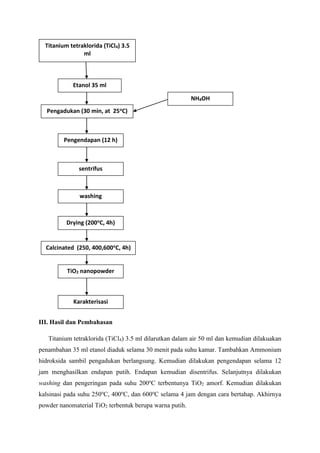
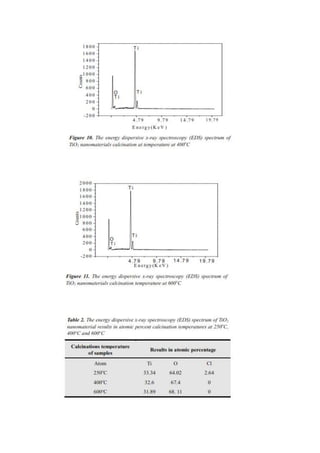
2. Hasil XRD menunjukan peningkatan suhu kalsinasi menyebabkan meniknya ukuran
partikel. TiO2 yang terbentuk berupa anatase.
3. Absorbansi dari ketiga suhu kalsinasi 200, 400, dan 600o
C sama-sama 350 nm dan
energi gabnya 3.54 eV dari hasil pengukuran UV-Vis.
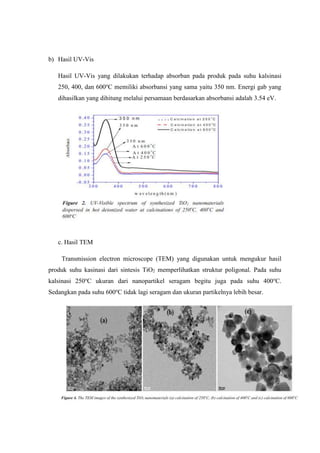
4. TiO2 yang dihasilkan berupa struktur poligonal, dan pada suhu kalsinasi 600o
C
memiliki kemurnian yang tinggi.
5. Hasil XRD dan TEM menunjukkan dengan meningkatnya suhu kalsinasi, ukuran
pertikel TiO2 juga lebih besar.
Reference
[1] Ismail Ab Rahman and Vejayakumaran Padavettan, Synthesis of Silica Nanoparticles
by Sol-Gel: Size-Dependent Properties, Surface Modification, and Applications in
Silica-Polymer Nanocomposites—A Review, Journal of Nanomaterials Volume 2012,
15 pages.
[2] Brinker, C. Jeffrey. Sol-Gel Science : The Physics And Chemistry Of Sol-Gel
Processing. Academic Press, Inc. An Imprint of Elsevier 1250 Sixth Avenue, San
Diego.
[3] Zawrah, M. F., El-Kheshen, A. A., Abd-El-All, H., Facile and Economic Synthesis of
Silica Nanoparticles, Journal of Ovonic Reasearch, vol.5, No.5, 2009, pp.129-133
[4] Ibrahim, I. A. M., Zikry, A. A. F., Sharaf, M. A., Preparation of Sperical silica
Nanoparticles: Ströber Silica, Journal of American Science, vol.6, No.11, 2010,
pp.985-989.
[5] Sarbjit kaur, Niraj Bala and Charu Khosla, Preparation and Deposition of
Hydroxyapatite on Biomaterials by Sol-Gel Technique-A Review, Chitkara Chemistry
Review 2013, Vol. 1, No. 2 ,pp. 59–69.
[6] Singh, L. P., Agarwal, S. K., Bhattacharyya, S. K., Sharma, U., Ahalawat, S.,
Preparation of Silica Nanoparticles and Its Beneficial Role in Cementitious Materials,
Nanomater Nanotechnol, vol.1, No.1, 2011, pp.44-51.](https://image.slidesharecdn.com/tugassolgel-141229083613-conversion-gate01/85/Sol-gel-15-320.jpg)
![[7] Dwi Wahyu Nugroho, Putri RiskiaAkwalia, Tito Prastyo Rahman, RadyumIkono,
Wahyu Bambang Widayanto, Agus Sukarto, Siswanto dan Nurul Taufiqu Rochman,
Pengaruh Variasi pH Pada Sintesis Nanopartikel, ZnO Dengan Metode Sol-
Gel. Prosiding Pertemuan Ilmiah Ilmu Pengetahuan dan Teknologi Bahan 2012.
[8] Stotaw Talbachew Hayle, Girma Goro Gonfa, Synthesis And Characterization Of
Titanium Oxide Nanomaterials Using Sol-Gel Method, American Journal of
Nanoscience and Nanotechnology 2014; 2(1): 1-7.](https://image.slidesharecdn.com/tugassolgel-141229083613-conversion-gate01/85/Sol-gel-16-320.jpg)