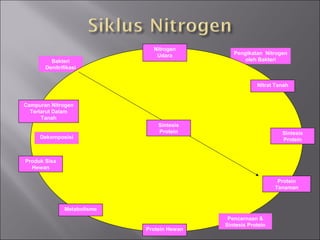
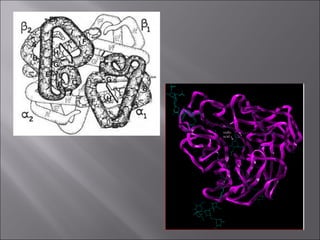
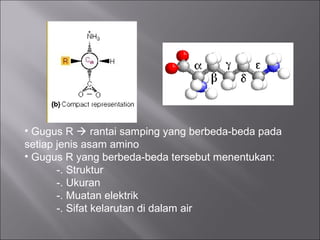
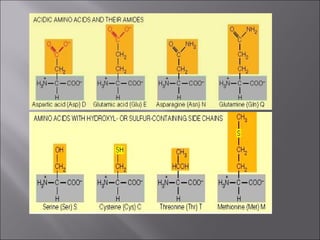
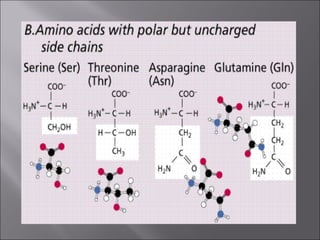
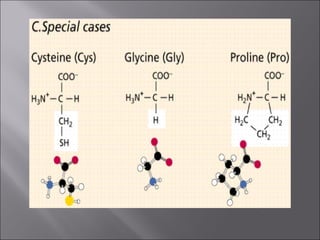
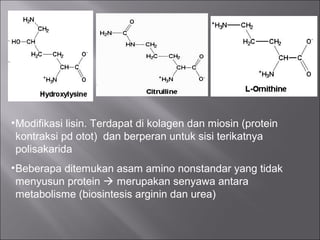
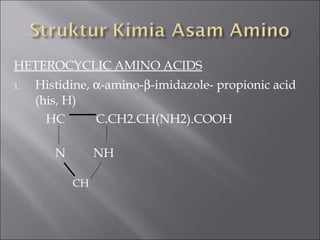
Dokumen ini membahas tentang protein, yang merupakan konstituen organik utama dalam otot, serta komposisi, struktur, dan fungsinya. Protein tersusun dari asam amino dan memiliki berbagai peran biologis, termasuk sebagai enzim, hormon, dan antibodi. Terdapat klasifikasi protein berdasarkan fungsi dan komposisi, serta pengaruh struktur asam amino dalam sifat dan reaksi protein.