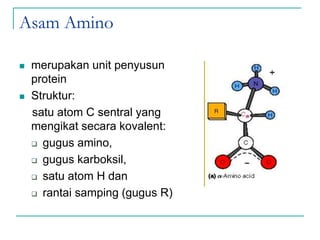
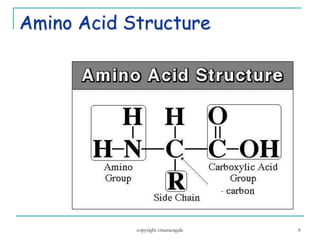
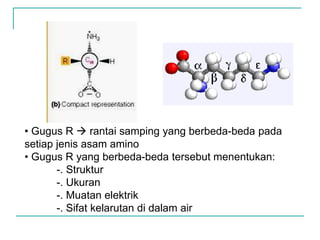
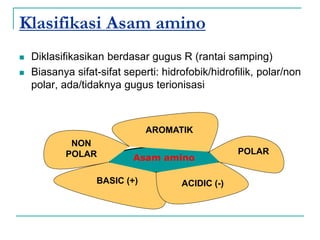
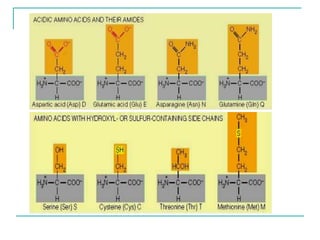
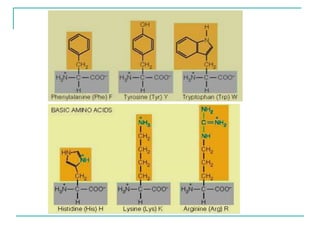
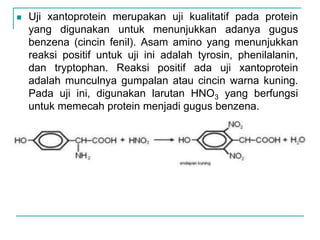
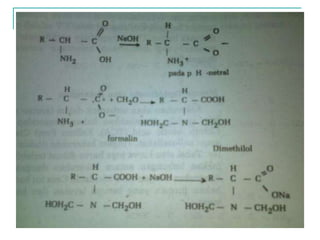
Dokumen ini membahas tentang asam amino dan protein, yang merupakan komponen penting dalam tubuh manusia dan memiliki berbagai fungsi biologis, seperti sebagai enzim, pengangkut, dan penunjang mekanis. Protein terdiri dari 20 jenis asam amino yang dibedakan menjadi esensial dan non-esensial, dan dapat terpengaruh oleh kondisi fisikokimia yang dapat menyebabkan denaturasi. Berbagai metode uji kualitatif dan kuantitatif dijelaskan untuk menentukan keberadaan dan jumlah protein dalam larutan.