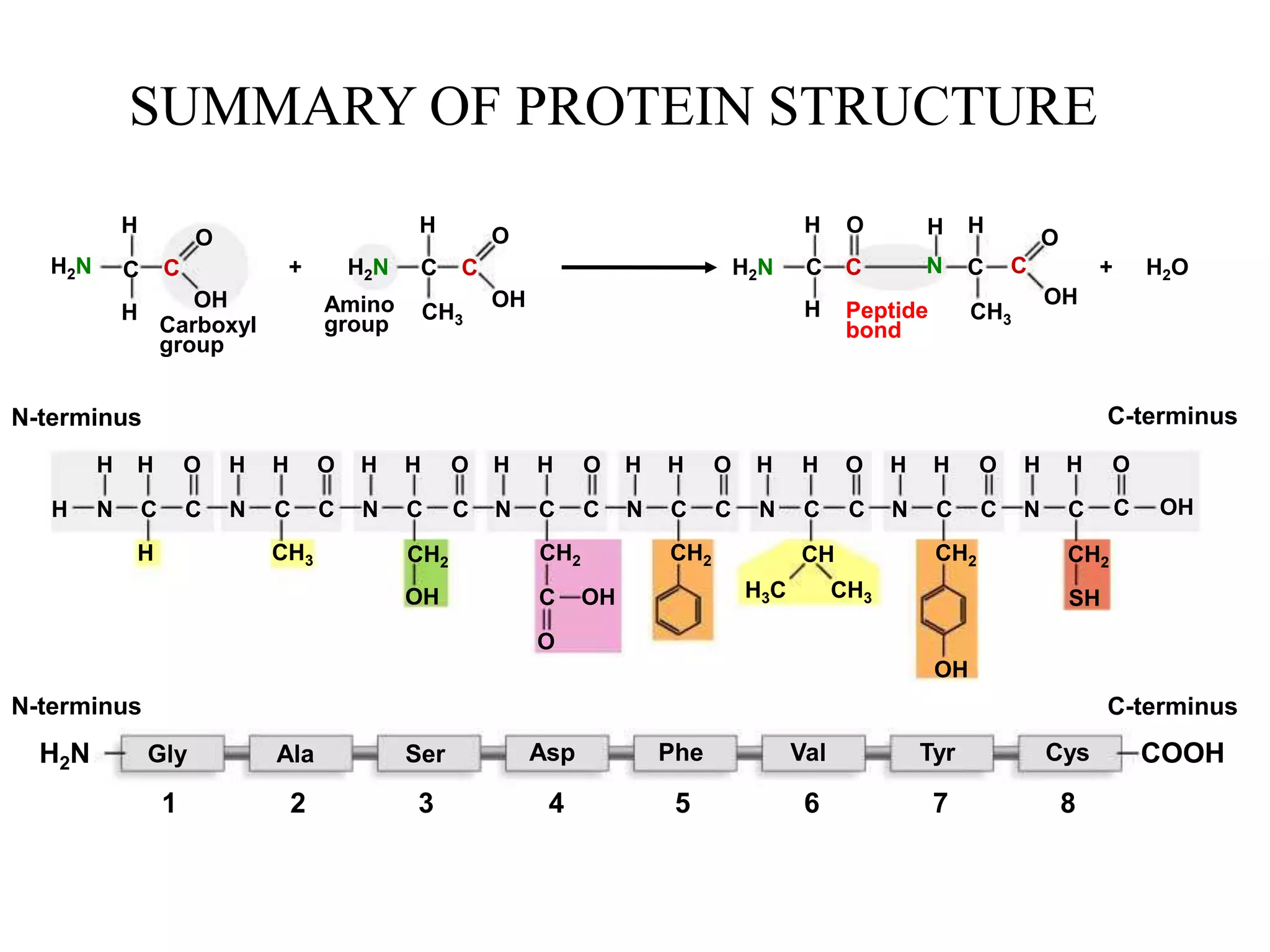
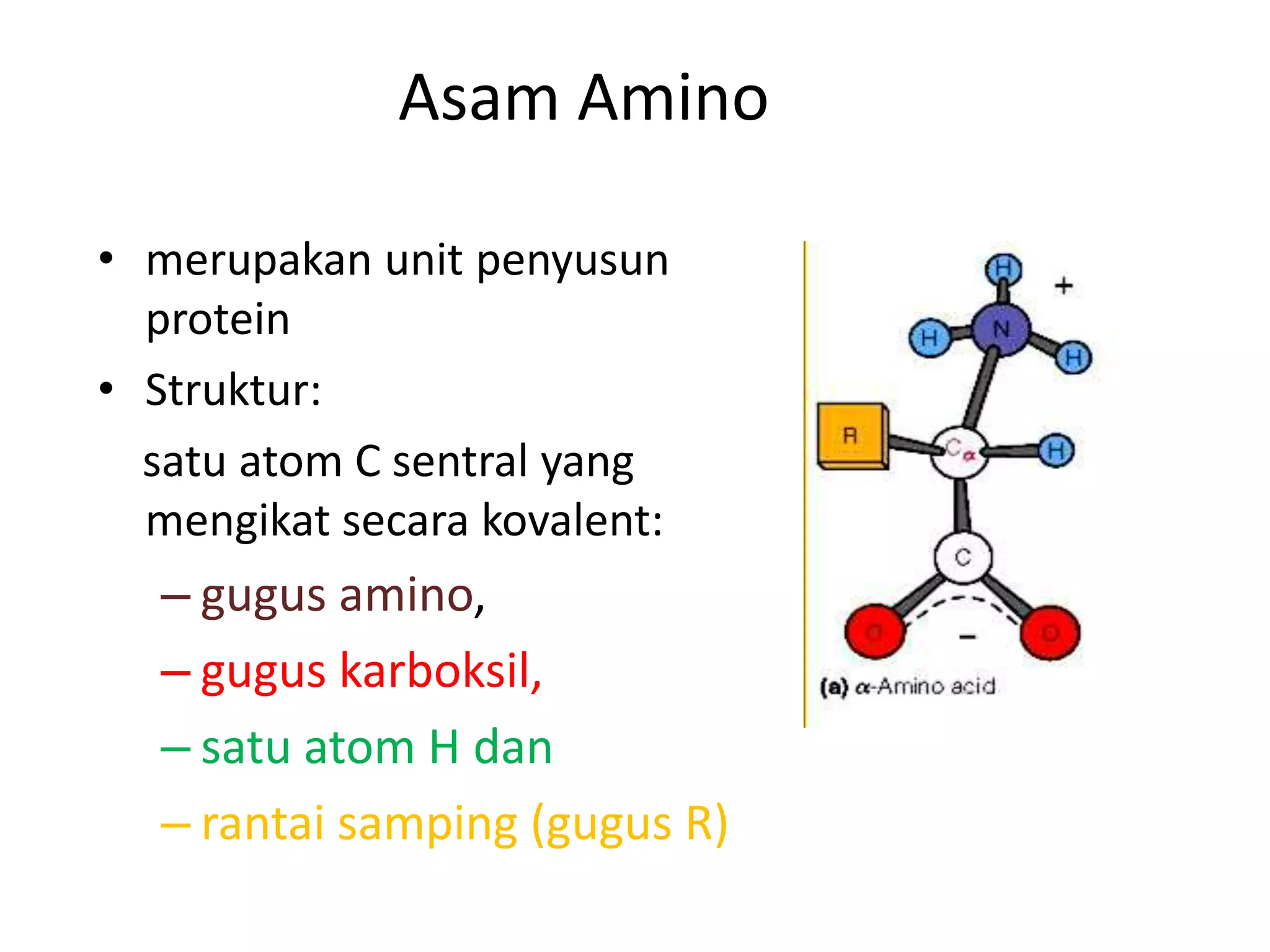
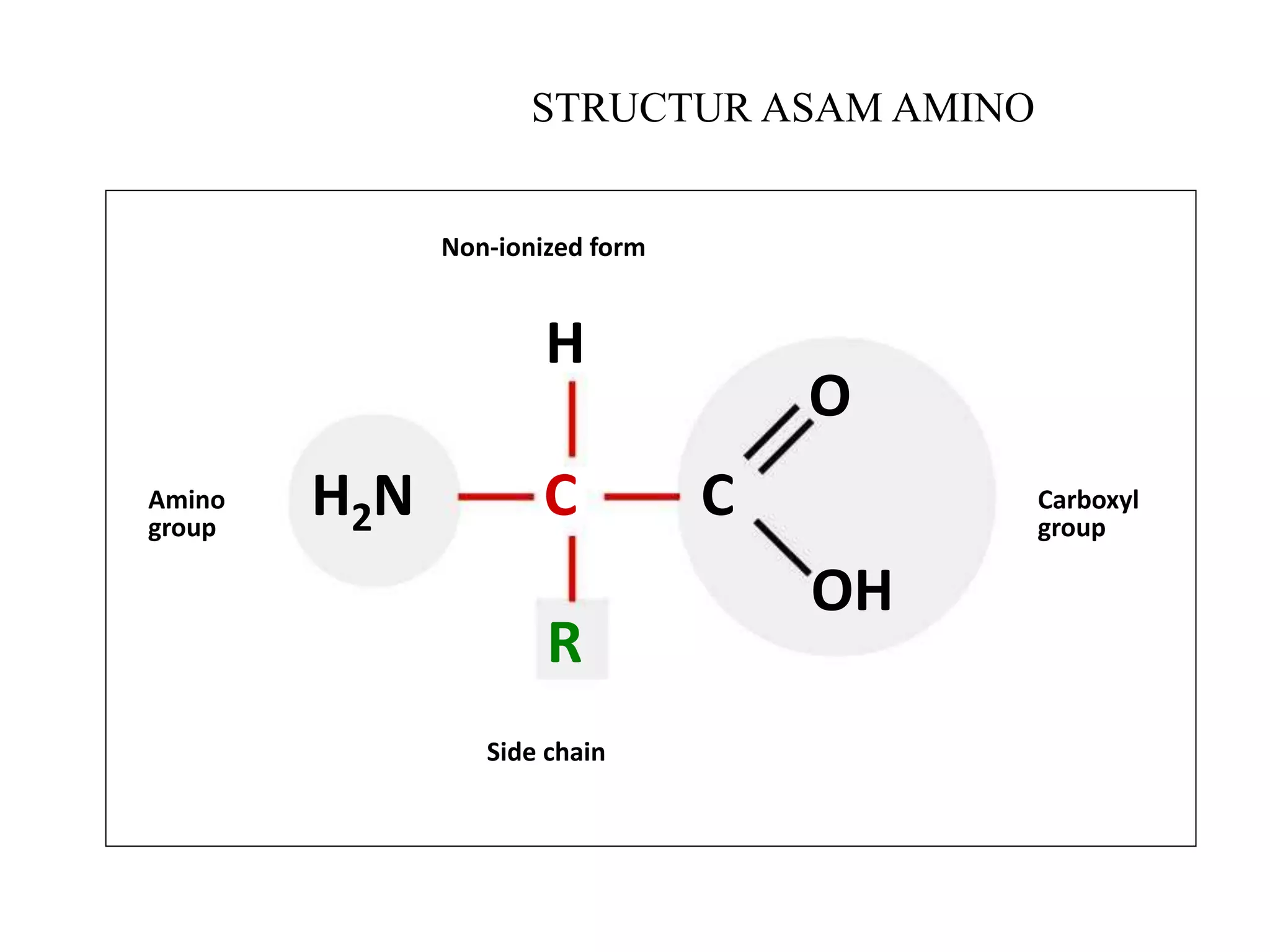
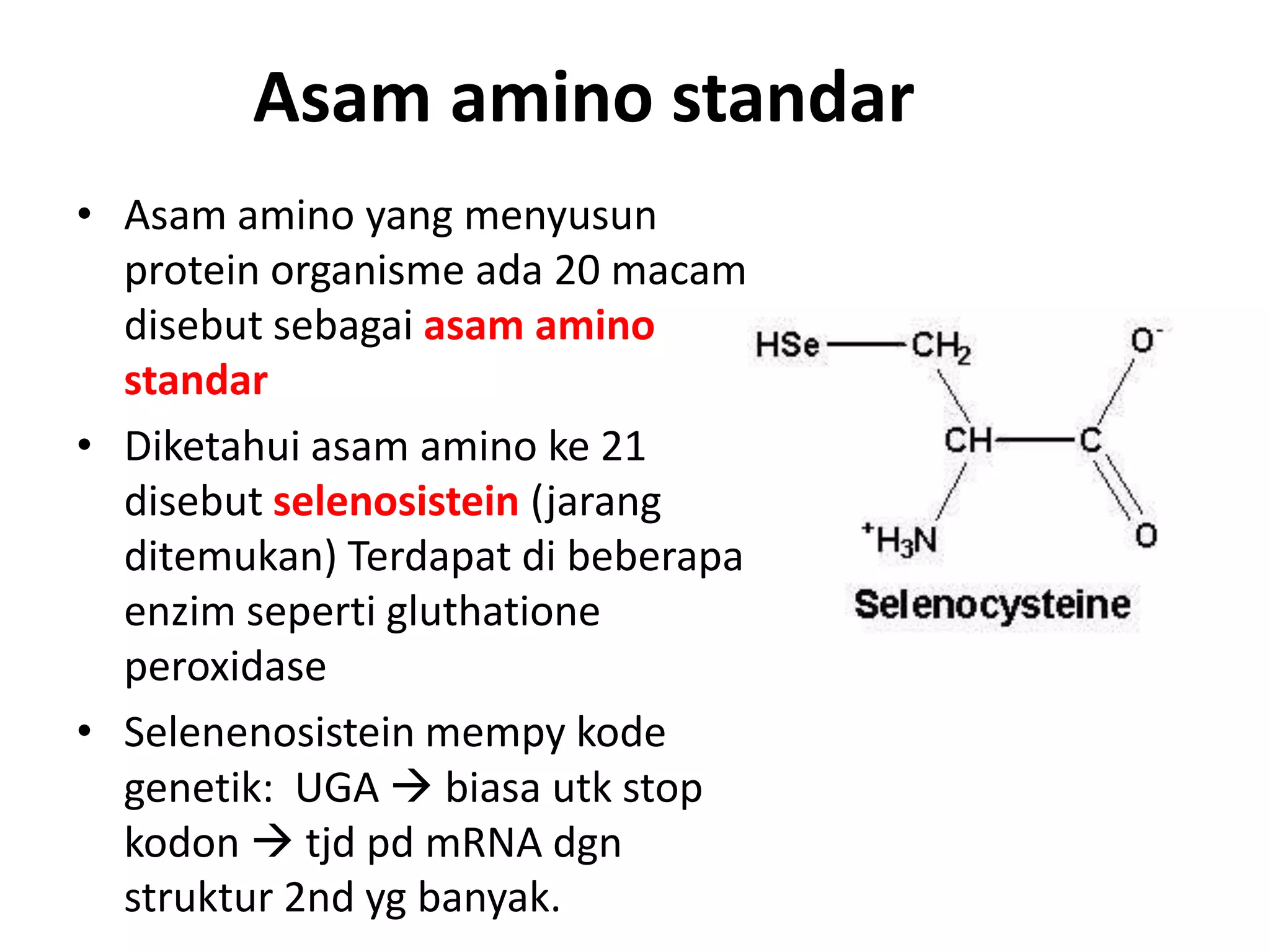
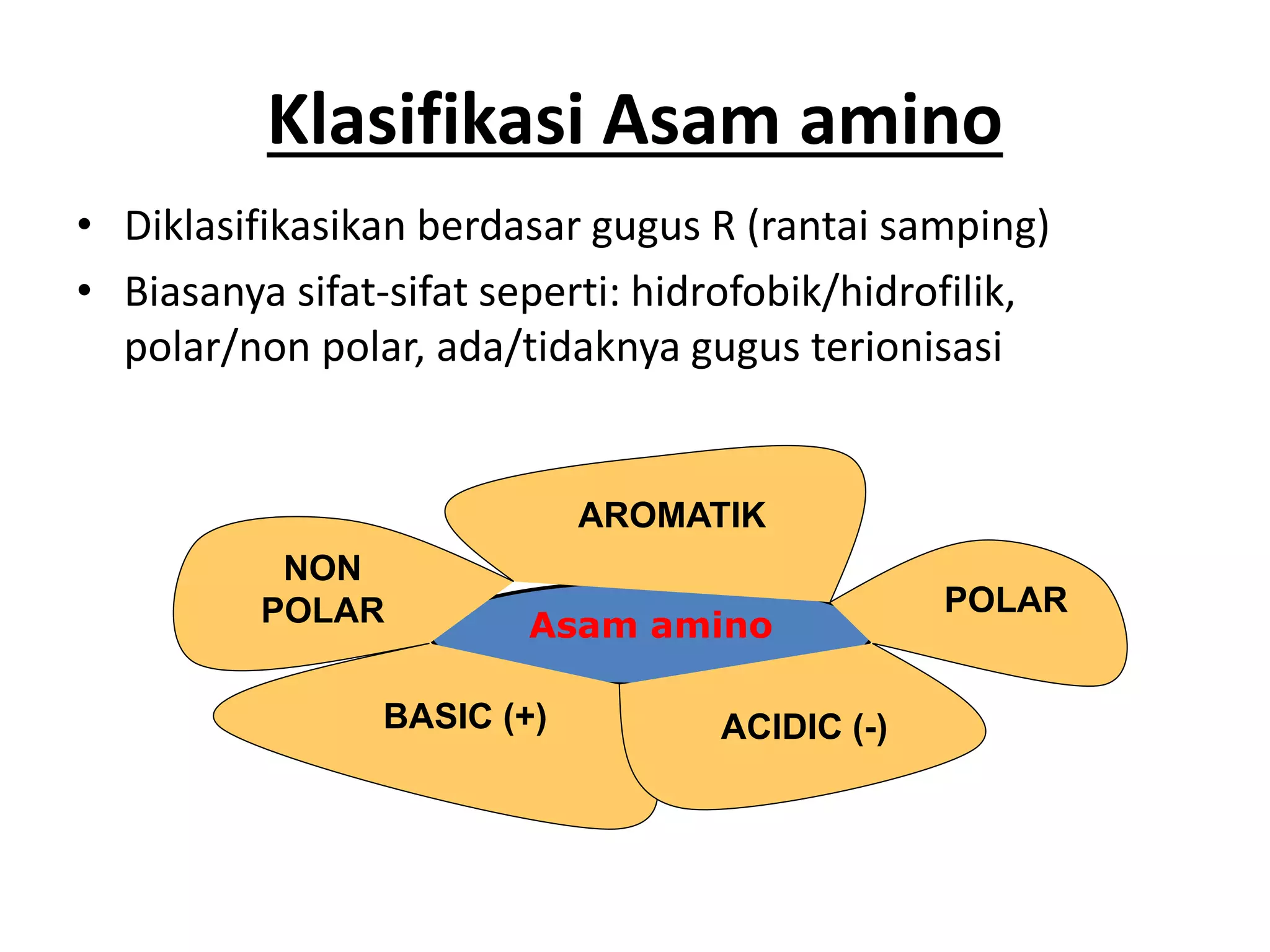
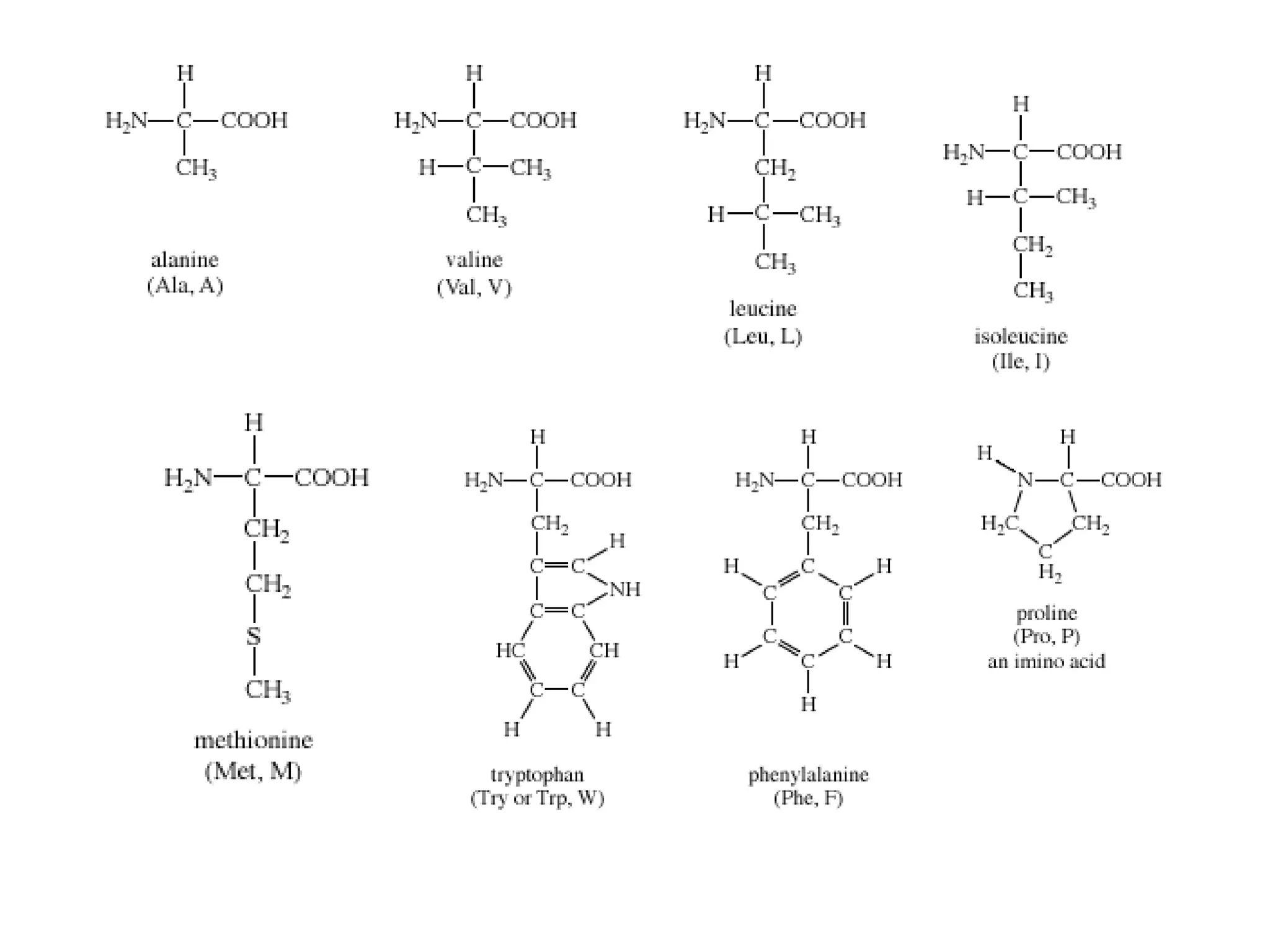
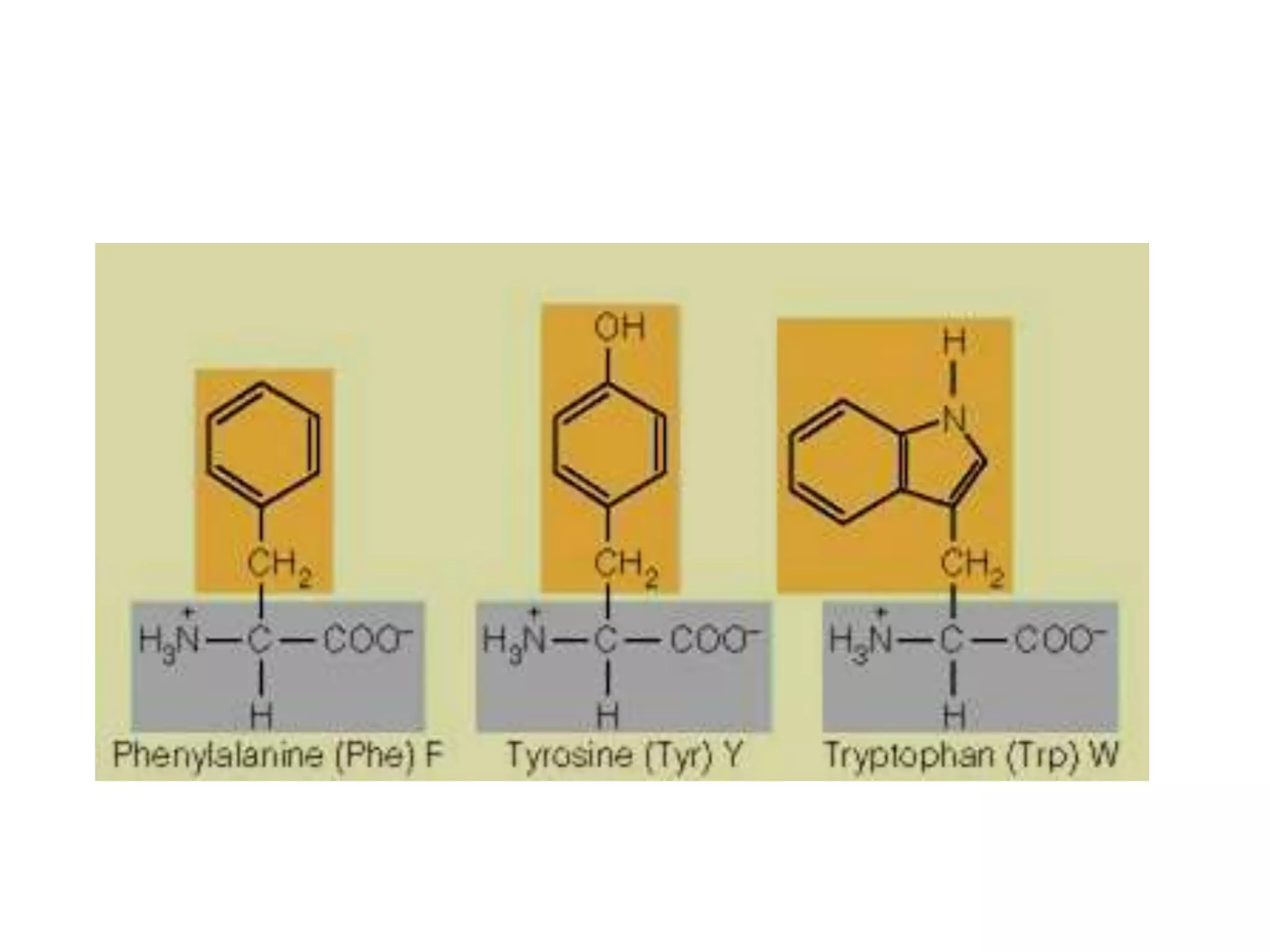
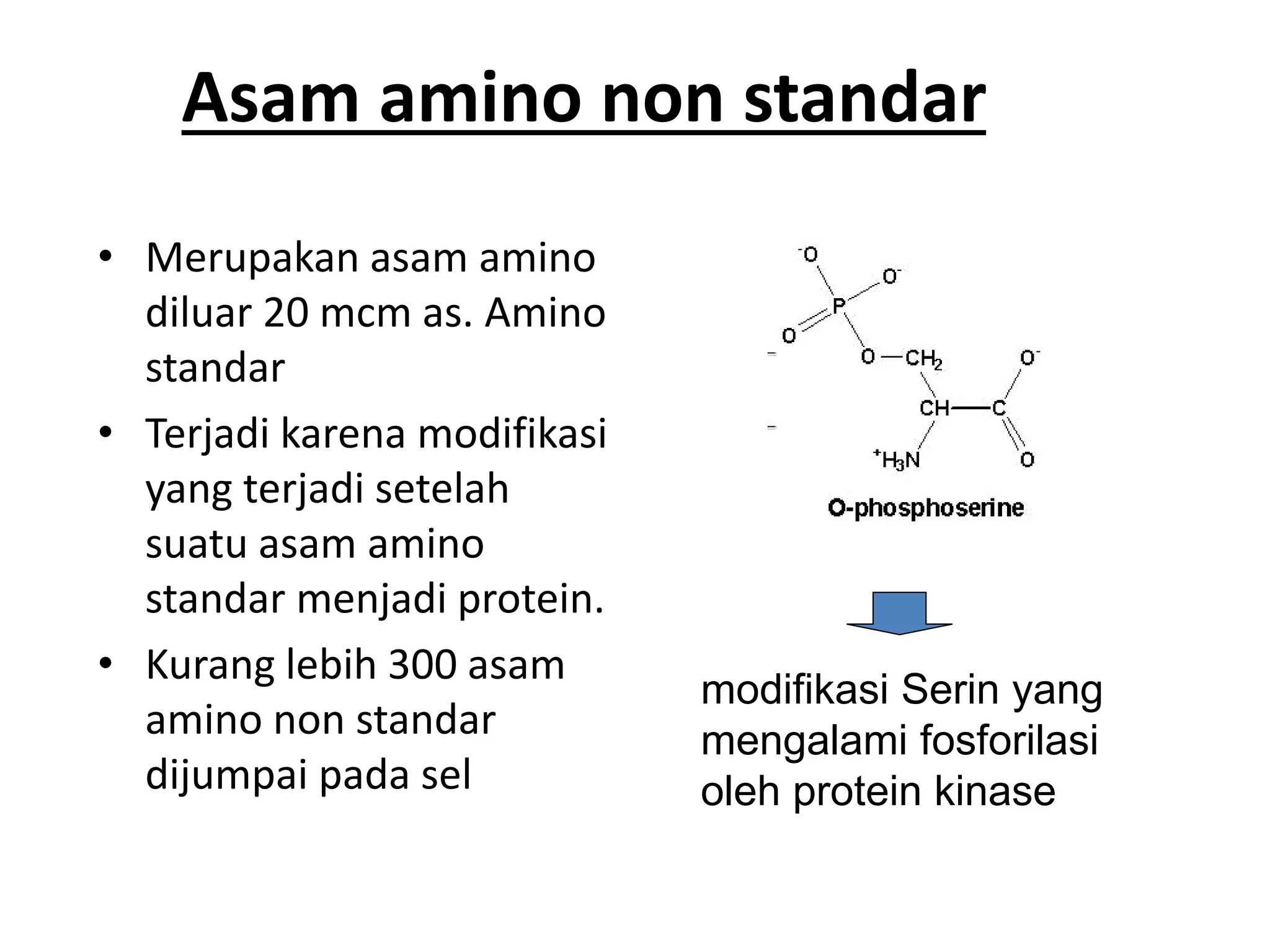
Protein merupakan polipeptida yang terdiri dari 20 jenis asam amino. Protein memiliki peran penting sebagai enzim, struktur sel, transportasi, dan proses informasi dalam tubuh. Protein dibentuk melalui ikatan peptida antar asam amino dan dapat dikelompokkan menjadi protein serat dan globular.