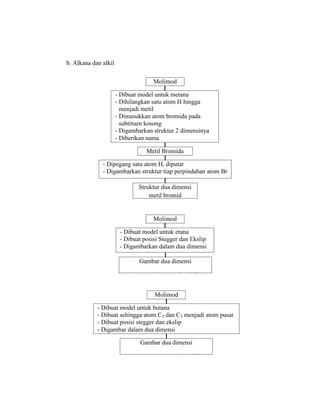
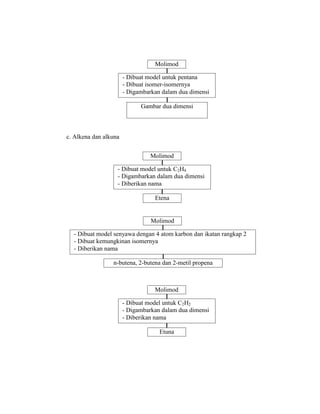
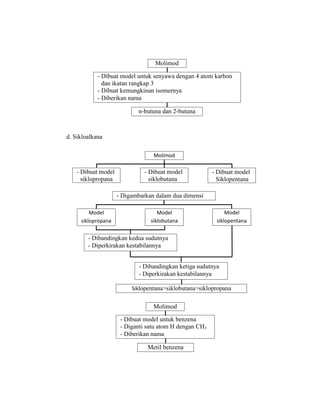
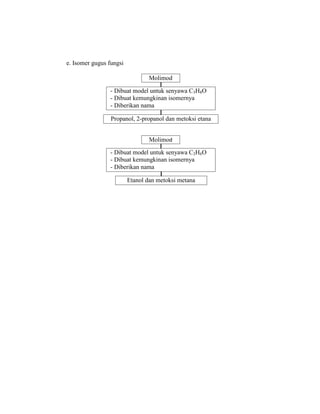
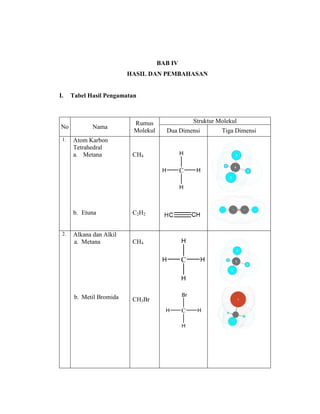
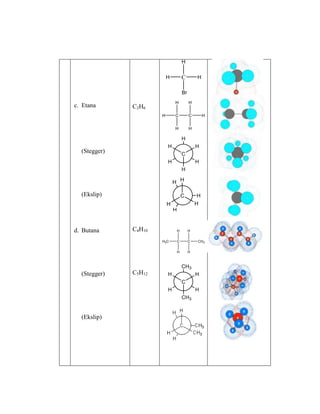
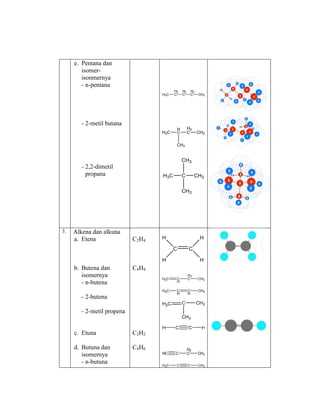
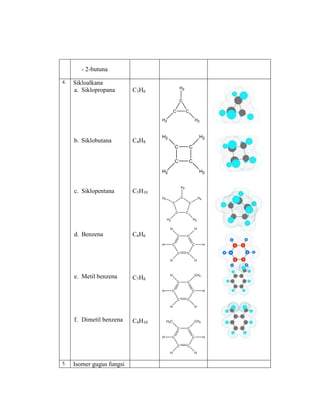
Praktikum ini bertujuan untuk membuat model-model molekul senyawa organik seperti hidrokarbon dan menggambarkannya dalam dua dan tiga dimensi untuk memahami struktur dan isomer mereka. Berdasarkan hasil percobaan, model-model molekul dapat dibuat dan digambar menggunakan molimod dan perangkat lunak kimia lainnya.