Dokumen ini membahas pengertian dan sifat asam, basa, dan garam dalam kimia. Asam didefinisikan sebagai senyawa yang memberi proton, sedangkan basa sebagai senyawa yang menerima proton atau menghasilkan ion hidroksida. Selain itu, dokumen ini menjelaskan konsep pH dan metode hidrolisis dalam larutan garam.
![Teori Asam
Pengertian
Asam (yang sering diwakili dengan rumus umum HA) secara umum merupakan
senyawa kimia yang bila dilarutkan dalam air akan menghasilkan larutan dengan
pH lebih kecil dari 7. Dalam definisi modern, asam adalah suatu zat yang dapat
memberi proton (ion H+) kepada zat lain (yang disebut basa), atau dapat menerima
pasangan elektron bebas dari suatu basa. Suatu asam bereaksi dengan suatu basa
dalam reaksi penetralan untuk membentuk garam. Contoh asam adalah asam
asetat (ditemukan dalam cuka) dan asam sulfat (digunakan dalam baterai atau aki
mobil). Asam umumnya berasa masam; walaupun demikian, mencicipi rasa asam,
terutama asam pekat, dapat berbahaya dan tidak dianjurkan.
Berbagai definisi asam
Istilah "asam" merupakan terjemahan dari istilah yang digunakan untuk hal yang
sama dalam bahasa-bahasa Eropa seperti acid (bahasa Inggris), zuur (bahasa
Belanda), atau Säure (bahasa Jerman) yang secara harfiah berhubungan dengan
rasa masam. Dalam kimia, istilah asam memiliki arti yang lebih khusus. Terdapat
tiga definisi asam yang umum diterima dalam kimia, yaitu definisi Arrhenius,
Bronsted-Lowry dan Lewis.
1. Arrhenius: Menurut definisi ini, asam adalah suatu zat yang
meningkatkan konsentrasi ion hidronium (H3O+) ketika dilarutkan dalam
air. Definisi yang pertama kali dikemukakan oleh Svante Arrhenius ini
membatasi asam dan basa untuk zat-zat yang dapat larut dalam air.
Menurut Svante Arrhenius : asam adalah zat yang dalam air dapat
melepaskan ion [H+]. Asam merupakan senyawa yang dapat menghasilkan
ion Hidrogen [H+], larutan asam mempunyai rasa asam dan bersifat
korosif.
Teori Dasar :](https://image.slidesharecdn.com/microsoft-word-teori-asam-basa-garam-121202090552-phpapp02/85/Microsoft-word-teori-asam-basa-garam-1-320.jpg)
![Svante August Arrhenius pada tahun 1887 menyatakan bahwa : “
Molekul-molekul elektrolit selalu menghasilkan ion-ion negatif dan positif
jika dilarutkan dalam air “
Selanjutnya pada tahun 1900 Svante Arrhenius mengemukakan
teori yang dikenal samapi sekarang yaitu Teori Asam Basa Arrhenius. “
asam merupakan suatu senyawa yagn dapat menghasilkan ion Hidrogen
[H+] bila dilarutkan dalam air dan Basa merupakan suatu senyawa yang
dapat memberikan ion Hidroksida (OH) bila dilarutkan dalam air.
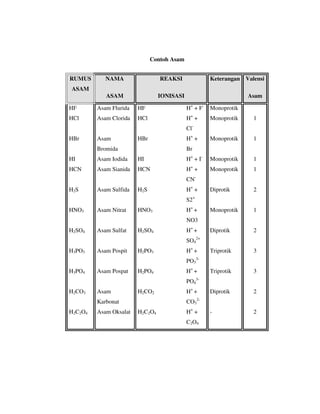
Asam
1. Asam Nitrat dalam air
HNO3 H+ + NO3
2. Asam Klorida dalam air
HCl H+ + Cl-
Setiap molekul HNO3 dan HCl hanya dapat menghasilkan 1 ion H+ disebut
Valensi Asam. Asam semacam ini disebut juga asam monoprotik.
Asam yang setiap molekul cairnya menghasilkan 2 ion H+ disebut asam
diprotik.
Asam yang setiap molekul cairnya menghasilkan 3 ion H+ disebut asam
triprotik.
Asam diprotik dan asam triprotik dikelompokkan kedalam asam
poliprotik.
2. Brønsted-Lowry: Menurut definisi ini, asam adalah pemberi proton
kepada basa. Asam dan basa bersangkutan disebut sebagai pasangan asam-](https://image.slidesharecdn.com/microsoft-word-teori-asam-basa-garam-121202090552-phpapp02/85/Microsoft-word-teori-asam-basa-garam-2-320.jpg)


![Teori Basa
Pengertian
Definisi umum dari basa adalah senyawa kimia yang menyerap ion
hydronium ketika dilarutkan dalam air.
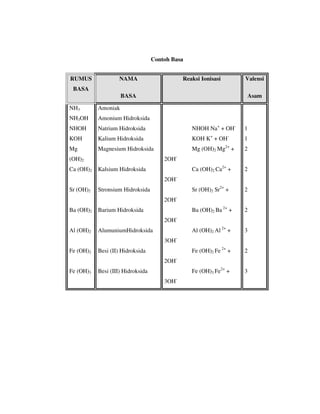
Menurut Svante Arrhenius : Basa merupakan suatu senyawa yang dapat
menghasilkan ion Hidroksida [OH], bila dilarutkan dalam air mempunyai rasa
pahit dan bersifat kaustik.
Basa adalah lawan (dual) dari asam, yaitu ditujukan untuk unsur/senyawa
kimia yang memiliki pH lebih dari 7. Kostik merupakan istilah yang digunakan
untuk basa kuat. jadi kita menggunakan nama kostik soda untuk natrium
hidroksida (NaOH) dan kostik postas untuk kalium hidroksida (KOH). Basa dapat
dibagi menjadi basa kuat dan basa lemah. Kekuatan basa sangat tergantung pada
kemampuan basa tersebut melepaskan ion OH dalam larutan dan konsentrasi
larutan basa tersebut.
Reaksi: Kalsium Hidroksida + Asam Sulfat ————> Kalsium
Sulfat + Air
Ca(OH)2 (aq) + H2SO4 ————> CaSO4(aq) + 2H2O
Teori Dasar
Svante August Arrhenius pada tahun 1887 menyatakan bahwa : “
Molekul-molekul elektrolit selalu menghasilkan ion-ion negatif dan positif jika
dilarutkan dalam air “
Selanjutnya pada tahun 1900 Svante Arrhenius mengemukakan teori yang
dikenal samapi sekarang yaitu Teori Asam Basa Arrhenius. “Basa merupakan
suatu senyawa yang dapat memberikan ion Hidroksida (OH) bila dilarutkan dalam
air.](https://image.slidesharecdn.com/microsoft-word-teori-asam-basa-garam-121202090552-phpapp02/85/Microsoft-word-teori-asam-basa-garam-6-320.jpg)



![atau baa yang lemah. Reaksi antara ion-ion tersebut dengan air membentuk H3O+
atau OH disebut
Reaksi Hidrolisis (hidro = air dan lisis = penguraian)
Penentuan pH
Larutan garam yang berasal dari asam kuat dan basa lemah bersifat asam.
Larutan garam yang berasal dari asam lemah dan basa kuat bersifat basa.
Larutan garam yang berasal dari asam lemah dan basa lemah dapat bersifat
asam, basa dan netral. Ini tergantung pada bergantung pada kekuatan
relatif asam atau basa dari garam yang terbentuk. Untuk jenis garam ini
baik kation maupun anion dapat bereaksi dengan air (ter hidrolis), maka
dapat dikatakan bahwa garam jenis ini mengalami hidrolis total.
Untuk menentukan pH larutan garam yang bersal dari Asam lemah dan
Basa lemah, secara kuantitaif sukar dikaitkan dengan harga Ka dan Kb maupun
dengan konsentrat garamnya. pH yang tepat hanya dapat ditentukan dengan cara
pengukuran. Namun pH garam dapat diperkirakan dengan menggunakan rumus :
[H+] = Kw x Ka](https://image.slidesharecdn.com/microsoft-word-teori-asam-basa-garam-121202090552-phpapp02/85/Microsoft-word-teori-asam-basa-garam-11-320.jpg)
![pH KELARUTAN
ASAM & BASA
Indikator Universal
Ungu tua pH 14
Ungu kurang tua pH 13
Ungu muda pH 12
Ungu lebih muda pH 11
Ungu sangat muda pH 10
Indigo pH 9
Biru pH 8
Hijau pH 7
Kuning pH 6
Jingga pH 5
Merah sangat muda pH 4
Merah lebih muda pH 3
Merah pH 2
Merah agak tua pH 1
Dalam air murni harga [H+] sama dengan [OH-] yaitu 10-7, harga pH asam
dan basa mulai dari 1 sampai 14.
Untuk meyederhanakan penulisan seorang ahli kimia Denmark, S.P.L
Sorensen (1868 – 1939) pada tahun 1909 menggunakan skala untuk menyatakan
konsentrasi H+ suatu larutan. Skala tersebut diberi nama skala pH. Nilai pH sama
dengan negatif Logaritma konsentrasi ion H+. dituliskan sebagai berikut :
pH = - Log [H+]](https://image.slidesharecdn.com/microsoft-word-teori-asam-basa-garam-121202090552-phpapp02/85/Microsoft-word-teori-asam-basa-garam-12-320.jpg)
![Jika [H+] = x kali 10-n maka pH = n –
log x
Jika [H+] = 1 x 10-n maka pH = n
Sebaliknya Jika pH = n maka [H+] = x kali 10-n maka
pOH = - Log [OH+]
pH merupakan suatu parameter untuk
menyatakan tingkat keasaman larutan.
Larutan asam memiliki pH kurang dari 7
Larutan basa memiliki pH lebih dari 7
Larutan Netral pH = 7
pH dapat ditentukan dengan menggunakan indicator universal atau dengan pH
meter.
Batas-batas pH ketika indicator mengalami perubahan warna disebut Trayek
Perubahan Warna. Trayek Perubahan Warna warna lakmus adalah 5,5 – 8,8.
Trayek Perubahan Warna Beberapa Indikator
INDIKATOR Trayek Perubahan Warna Perubahan Warna
Metil Jingga 2.9 – 4.0 Merah º Kuning
Meril Merah 4.2 – 6.3 Merah º Kuning
Bromtimol biru 6.0 – 7.6 Kuning º Biru
Fenolftalein 8.3 – 10.0 Tidak berwarna º Merah](https://image.slidesharecdn.com/microsoft-word-teori-asam-basa-garam-121202090552-phpapp02/85/Microsoft-word-teori-asam-basa-garam-13-320.jpg)


