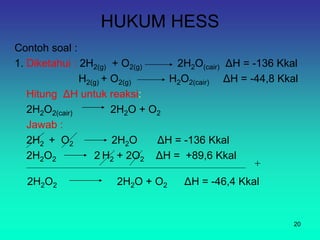
Dokumen ini membahas konsep energi dan perubahan energi dalam mekanika dan termokimia, termasuk jenis-jenis energi dan hukum kekekalan energi. Juga dijelaskan tentang kalorimeter, pengukuran kapasitas panas, reaksi eksoterm dan endoterm, serta hukum Hess dan hukum pertama termodinamika. Akhirnya, penjelasan disertai dengan contoh perhitungan untuk perubahan entalpi dalam reaksi kimia.