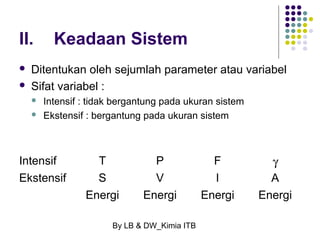
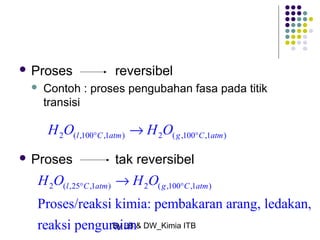
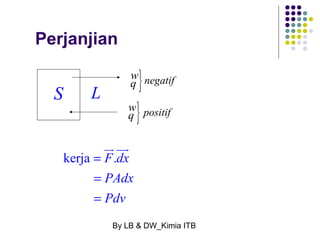
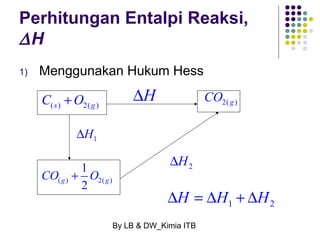
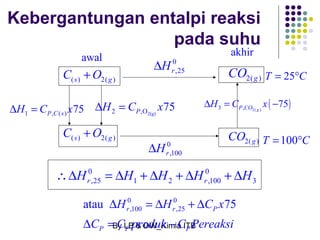
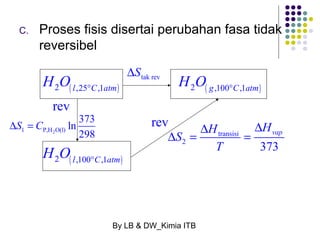
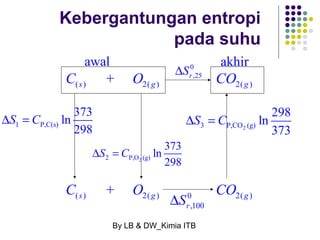
Dokumen tersebut membahas tentang energetika, termasuk konsep sistem dan lingkungan, jenis-jenis sistem, variabel keadaan sistem, fungsi keadaan dan proses, hukum pertama termodinamika mengenai kalor dan kerja, serta konsep-konsep terkait seperti entalpi dan entropi.



































![2. Perhitungan menggunakan data energi
bebas pembentukan standar DGf
DG 0 = éëDG 0 + 2 DG 0 - G 0
r f , CO ( g ) f , H O ( l ) ùû éëDf , CH ( g ) ùû
G x
G
D = éë- + - ùû - -
D = - <
Perjanjian 0 unsur dalam keadaan standar bernilai f DG NOL
By LB & DW_Kimia ITB
0
Contoh :
( ) 4( ) 2 2( ) 2 ( ) 2 CH g + O ®CO g + 2H O l P,T tetap
Ramalan fisis : DG < 0 (Mengapa?)
2 2 4
0 ( ) [ ]
0
394,36 2 237,18 50,75
817,97 kJ 0
r
r](https://image.slidesharecdn.com/energetikatermokimia-141203023901-conversion-gate02/85/Energetika-termokimia-43-320.jpg)