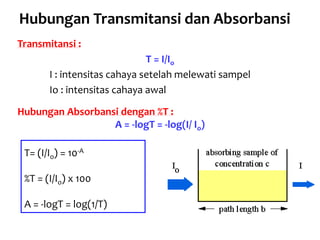
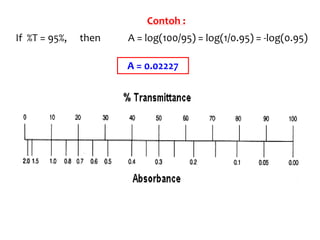
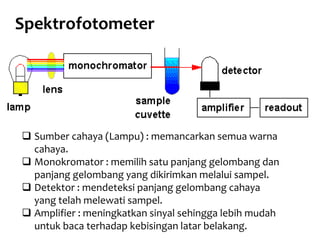
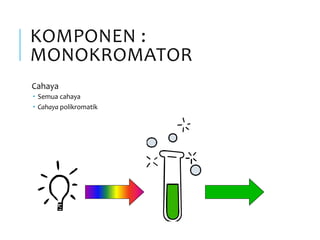
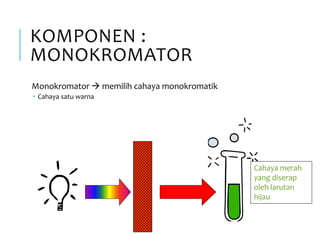
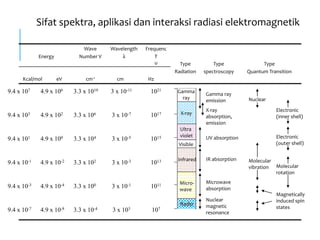
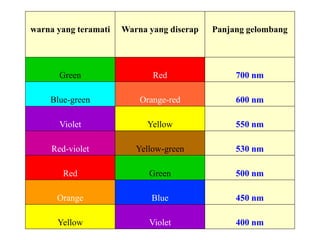
Spektrofotometri adalah teknik analisis kuantitatif yang mengukur intensitas cahaya yang diserap oleh larutan sampel. Prinsipnya berdasarkan hukum Lambert-Beer dimana absorbansi larutan berbanding lurus dengan konsentrasi zat. Spektrofotometer mengukur absorbansi dengan mendeteksi perbedaan intensitas cahaya sebelum dan sesudah melewati sampel. Hasil pengukuran dikonversi ke konsentrasi melalui kurva kalibrasi







![A = abc
A : absorbance
Hukum Lambert Beer – hubungan linear antara absorbansi
dengan konsentrasi zat yang diserap
Dasar pengukuran Spektrofotometer
“c” konsentrasi sampel dalam (mol/L)
“a” is molar absorptivity dalam
L/[(mol)(cm)]
“b” : panjang kuvet dalam cm
Diameter kuvet atau tempat sampel = jarak cahaya
yang melalui sampel yang diserap](https://image.slidesharecdn.com/kdmeeting7-150211033659-conversion-gate01/85/Kd-meeting-7-10-320.jpg)