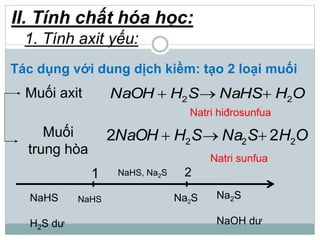
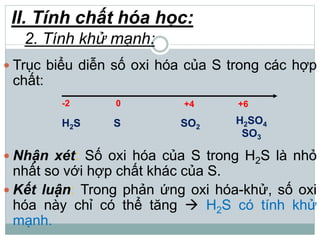
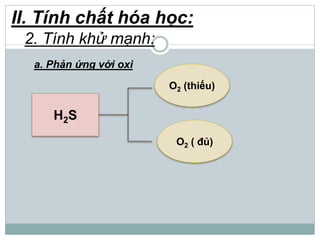
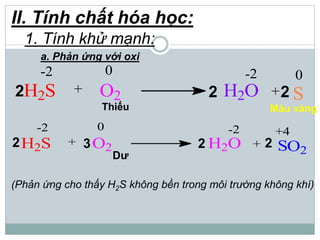
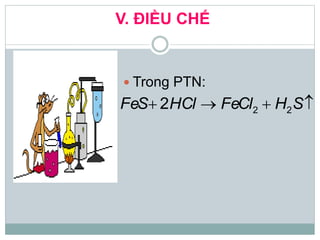
Khí hidro sunfua (H2S) là chất khí độc, có mùi trứng thối, nhẹ hơn không khí và ít tan trong nước. H2S có tính axit yếu, phản ứng với kiềm tạo ra muối natri hiđrosunfua và natri sunfua, đồng thời có tính khử mạnh khi phản ứng với oxi và brom. Trong tự nhiên, H2S sinh ra từ núi lửa, bãi rác và xác động vật, và có thể được điều chế trong phòng thí nghiệm từ phản ứng giữa bột sắt và axit hydrochloric.