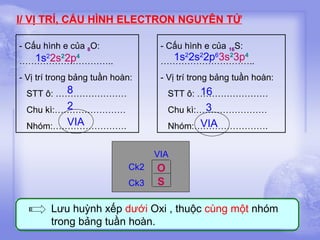
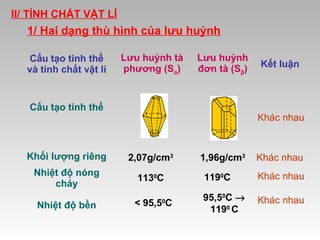
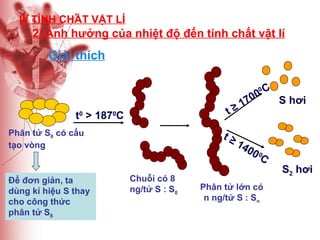
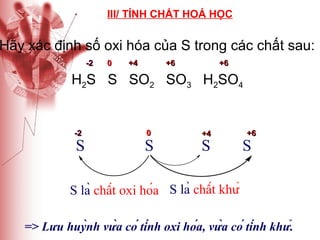
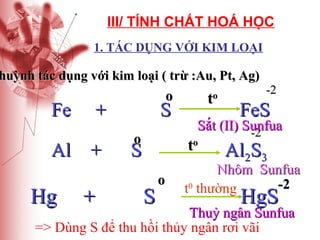
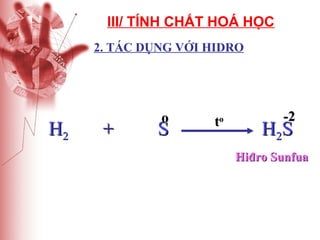
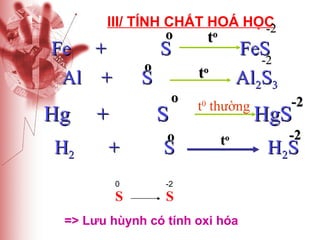
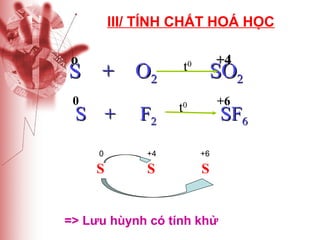
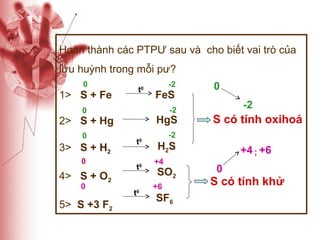
Tài liệu cung cấp thông tin về lưu huỳnh, bao gồm vị trí, cấu hình electron, tính chất vật lý và hóa học, cũng như ứng dụng của nó. Lưu huỳnh có hai dạng thù hình, và cả hai đều giống nhau về tính chất hóa học nhưng khác nhau về tính chất vật lý. Ngoài ra, tài liệu cũng đề cập đến ứng dụng của lưu huỳnh trong sản xuất axit sulfuric và các lĩnh vực khác.