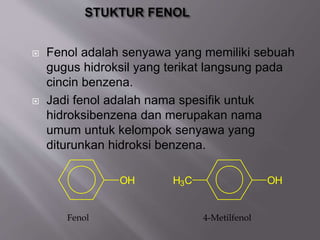
Fenol adalah senyawa organik yang memiliki gugus hidroksil terikat pada cincin benzena. Metode Folin Ciocalteu digunakan untuk menentukan kandungan fenol total dalam tanaman Kenikir dan Beluntas dengan membandingkannya dengan asam galat sebagai standar. Hasil analisis menunjukkan kandungan fenol tertinggi dalam Kenikir.