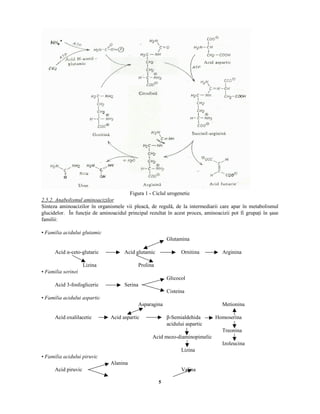
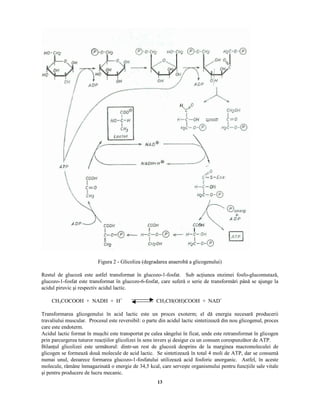
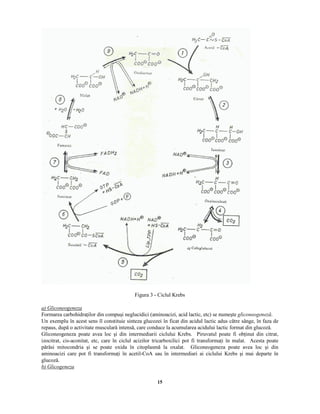
Documentul „Biochimia efortului fizic” de Lygia Alexandrescu analizează structura, compoziția și procesele biochimice fundamentale din organismele vii, inclusiv biosinteza și biodegradarea. Se discută despre metabolismul, rolul aminoacizilor și importanța acestora în sinteza proteinelor și enzimelor, precum și în procesul de antrenament pentru sportivi. Biochimia influențează performanța sportivă, evidențiind relația dintre nutriție și eficiența efortului fizic.